- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Азотная кислота
Содержание
- 3. Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
- 4. HNO3 как сильная одноосновная кислота взаимодействует:а) с основными и амфотерными оксидами:б) с основаниями:в) вытесняет слабые кислоты из их солей:
- 5. Азотная кислота в любой концентрации проявляет свойства
- 6. Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
- 7. С Ag и Pt азотная кислота, даже
- 8. Нитраты Азотная кислота является сильной кислотой. Её
- 9. Нитрат калия- бесцветные кристаллы Значительно менее гигроскопична
- 10. Нитрат аммония- Кристаллическое вещество белого цвета. Температура
- 11. Нитраты в водных растворах практически не проявляют
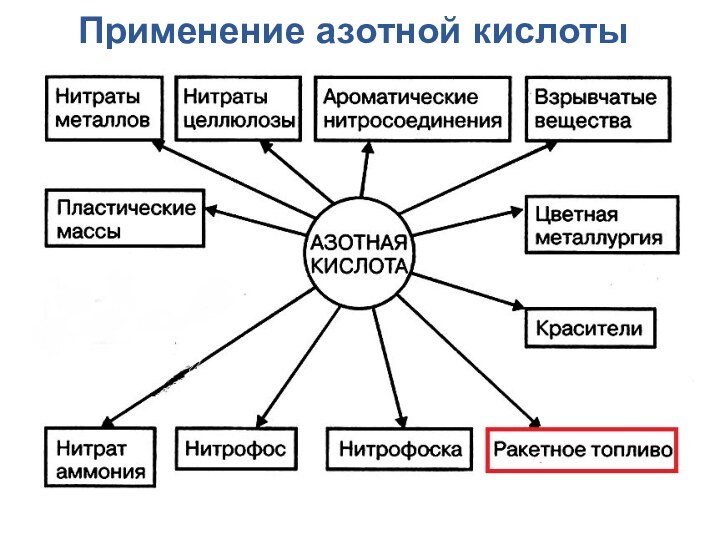
- 12. Применение азотной кислоты
- 14. Сырье: аммиак, воздух.Вспомогательные материалы: катализаторы (платинородиевые сетки),
- 15. Получение азотной кислоты в промышленности1) Окисление аммиака
- 16. Скачать презентацию
- 17. Похожие презентации
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:

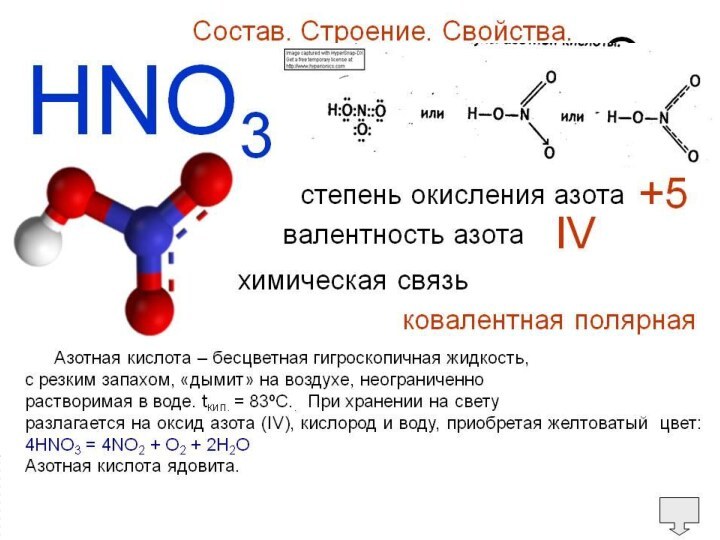













Слайд 3 Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на
свету процесса разложения:
Слайд 4
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
б) с основаниями:
в)
вытесняет слабые кислоты из их солей:
Слайд 5 Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя,
при этом азот восстанавливается до степени окисления от +4
до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:а) с металлами, стоящими в ряду
б) с металлами, стоящими в ряду напряжений левее водорода
Слайд 7 С Ag и Pt азотная кислота, даже концентрированная
не взаимодействует. Fe, Al, Cr холодной концентрированной азотной кислотой
пассивируются.(Fe)
(Al)
(Na)
Слайд 8
Нитраты
Азотная кислота является сильной кислотой. Её соли — нитраты —
получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы
в воде. Нитрат-ион в воде не гидролизуется.Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
г) нитрат аммония:
Слайд 9 Нитрат калия- бесцветные кристаллы Значительно менее гигроскопична по
сравнению с натриевой, поэтому широко применяется в пиротехнике как
окислитель. При нагревании выше 334,5ºС плавится, выше этой температуры разлагается с выделением кислорода.Нитрат натрия- применяется как удобрение; в стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей.
Слайд 10 Нитрат аммония- Кристаллическое вещество белого цвета. Температура плавления
169,6 °C, при нагреве выше этой температуры начинается постепенное
разложение вещества, а при температуре 210°С происходит полное разложение.Слайд 11 Нитраты в водных растворах практически не проявляют окислительных
свойств, но при высокой температуре в твердом состоянии являются
сильными окислителями, например, при сплавлении твердых веществ:Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
Слайд 14
Сырье: аммиак, воздух.
Вспомогательные материалы: катализаторы (платинородиевые сетки), вода,
концентрированная серная кислота.
Особенности технологического процесса:
Производство непрерывное.
Температура поддерживается за счет
выделяемой теплоты.Смесь, содержащую NO, охлаждают в котле-утилизаторе.
NO2 в поглотительной башне по принципу противотока смешивается с водой (массовая доля 60 %).
Концентрированную азотную кислоту получают при добавлении концентрированной серной кислоты.
Производство азотной кислоты
Слайд 15
Получение азотной кислоты в промышленности
1) Окисление аммиака на
платиновом катализаторе до NO
4NH3 + 5O2 → 4NO + 6H2O
(Условия: катализатор – Pt, t = 500˚С) 2) Окисление кислородом воздуха NO до NO2
2NO + O2 → 2NO2
3) Адсорбция (поглощение) NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O ↔ 4HNO3
или 3NO2 + H2O ↔ 2HNO3+NO (без избытка кислорода)