Слайд 4
История биотехнологии металлов
Слайд 5
Открытие микроорганизмов, важных для биогеотехнологии металлов
Слайд 8
Физико – химические основы выщелачивания металлов из руд
Слайд 9
Бактериальное окисление субстратов включает следующие стадии
взаимодействие поверхностных структур
бактерий с окисляемым субстратом (сорбция, адгезия);
изменение физико-химических свойств окисляемых
субстратов и их транспорт в клеточную стенку;
окисление субстратов в поверхностных структурах клеток;
транспорт электронов и протонов; образование мембранного потенциала;
синтез АТФ и образование воды.
Слайд 10
Окисление Fe
Окисление Fe 2+ грамотрицательным A. ferrooxidans
связано с его транспортом в периплазматическое пространство клетки.
При переносе
электронов на ЦПМ возникает трансмембранный электрохимический градиент ионов водорода, который состоит из электрического и химического компонентов. Этот электрохимический потенциал обеспечивает синтез АТФ. Со второй половиной реакции окисления Fe2+ (2ё + 2Н+ + '/202 —>Н2О) связан также механизм регуляции внутриклеточного pH, равного 6,5.
Слайд 11
Окисление серы и сульфидных минералов.
Японскими исследователями были
открыты ферменты серо- (сульфид)-Ре +-оксидоредуктаза (S° + 4Fe +
+ ЗН20 —» H2S03 + + 4Fe + + 4Н+) и сульфит-Fe +-оксидоредуктаза (H1SO3 + 2Fe+ + I 4Н20 1H2S04 I 2Fe | 2Н+).
Слайд 12
Механизм первичных реакций окисления серы и сульфидных минералов
Элементная сера растворяется в веществах липидной природы до коллоидного
состояния и поступает в периплазматическое пространство, где и окисляется.
В основе окисления сульфидных минералов лежит биоэлектрохимический процесс. Бактерии благодаря сорбции клеток и действию экзометаболитов на минералы изменяют их электродный потенциал, заряд, повышают электропроводность среды, создают высокий окислительно-восстановительный потенциал среды, создают определенную разность потенциалов между минералом и средой-электролитом
Слайд 13
Размеры частиц и плотность пульпы
Размеры частиц руды или
концентрата определяют площадь их поверхности, от которой зависит адгезия
бактерий и скорость окислительных процессов.
Слайд 14
Влияние химических элементов.
Токсичность металлов для бактерий зависит от
физиологического состояния бактерий, химического состояния металлов и степени их
взаимодействия в среде.
К наиболее токсичным катионам относят Cd, Ag, Hg и U. Анионы Se, As и Mo более токсичны, чем большинство катионов металлов.
Слайд 15
Источники питания
Важнейшими элементами для жизнедеятельности хемолитотрофных бактерий в
биогидрометаллургии являются азот и фосфор. С солями азота и
фосфора поступает и калий.
Слайд 16
Влияние микробиологических факторов.
Фенотипическая вариабельность бактерий является результатом
1)
активности геномной регуляторной системы
2) адаптации их к новым
условиям среды, а штаммовый полиморфизм выражается в разнообразии структуры хромосомной ДНК.
Слайд 17
Влияние температуры
При снижении температуры с 26 до 15
°С средняя удельная скорость роста различных штаммов A. ferrooxidans
уменьшалась в 2,8—4 раза, а средняя скорость окисления Fe + — в 2,3 — 3 раза.
При снижении температуры с 15 до 8 °С эти величины уменьшались в 6,1 — 13,3 и 4,5 —8,0 раз соотвественно.
L.ferrooxidans резко снижает окислительную активность при температуре ниже +14 °С.
Слайд 18
Биогидрометаллургические технологии переработки руд и концентратов
Слайд 19
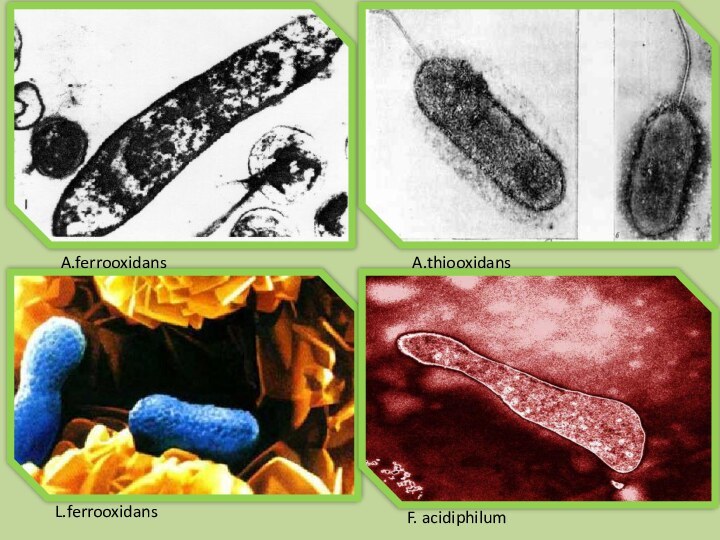
A.ferrooxidans
A.thiooxidans
L.ferrooxidans
F. acidiphilum
Слайд 20
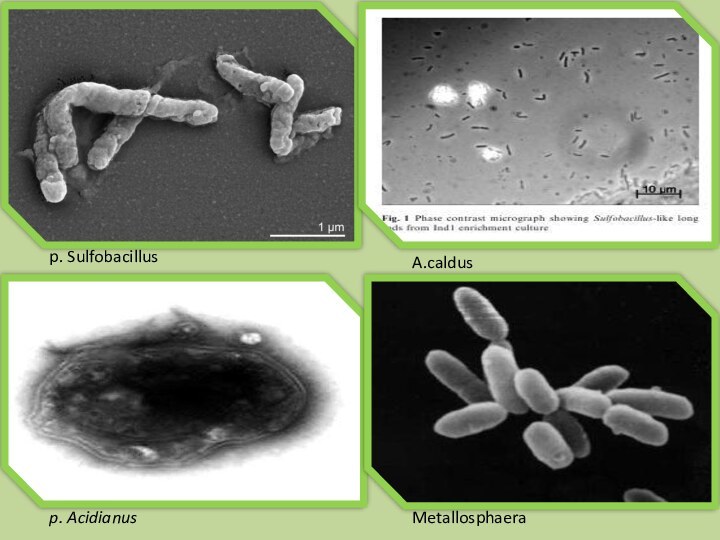
p. Sulfobacillus
A.caldus
p. Acidianus
Metallosphaera
Слайд 21
Кучное и подземное выщелачивание меди

Бактериальнохимическое выщелачивание цветных металлов проводят из отвалов бедной руды
(кучное) и из рудного тела в месте залегания (подземное).
Орошение дробленой руды в отвале или в рудном теле осуществляется водными растворами H2S04, содержащими Fe3*, 02 и бактерии. Сульфидные минералы окисляются, а цветные металлы в кислой среде переходят в растворимое состояние. Металлы из растворов либо извлекают цементацией, либо концентрируют методом экстракции и затем извлекают электролизом. После извлечения ценных элементов растворы опять поступают на орошение руды (схема замкнутая)
При нормальной и пониженной температуре катализируют хемолитотрофные бактерии A.ferrooxidans, A.thiooxidans, L.ferrooxidans и F. acidiphilum.
В зонах разогрева руды при температуре 55 °С широко распространены умеренно-термофильные бактерии p. Sulfobacillus и A.caldus.
При температуре выше 50 °С вплоть до 80 °С в окислительных процессах участвуют термофильные бактерии p. Acidianus и Metallosphaera.
Слайд 22
1 — аэрация рециркулирующего раствора;
2 — насосная станция; 3 -- распределительный трубопровод для
подачи растворов; 4 — клапан; 5 — коллектор; 6 — гибкий полиэтиленовый шланг; 7 — нагнетательные скважины; 8 — рудное тело; 9 — дренажные желоба; 10 — насос для подачи продуктивны* раствором; II — лимниграфная установка; 12 — отстойник; 13 — желоб для осаждения мели; 14 — бункеры для меди; 15 — компрессорная установка
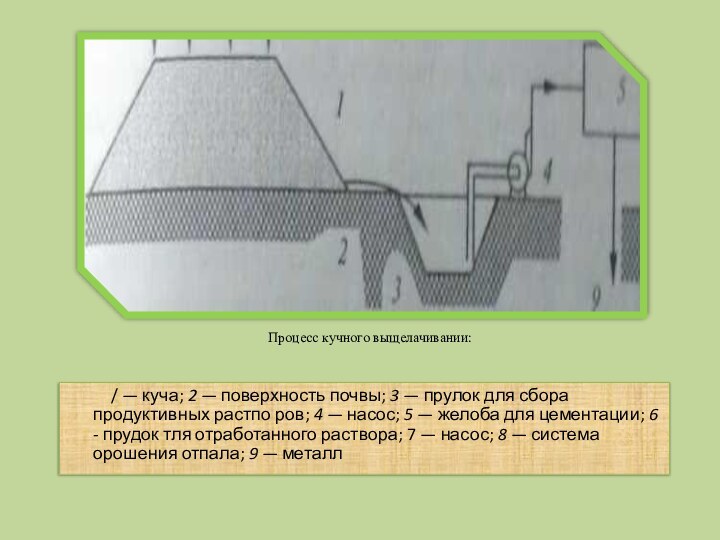
куча; 2 — поверхность почвы; 3 — прулок для
сбора продуктивных растпо ров; 4 — насос; 5 — желоба для цементации; 6 - прудок тля отработанного раствора; 7 — насос; 8 — система орошения отпала; 9 — металл
Слайд 24
Подземное и кучное выщелачивание урана
Уран в
рудах присутствует в основном в четырехвалентном состоянии в виде
таких минералов, как ураноторит, уранинит. Эти соединения урана не растворимы в серной кислоте.Бактерии A. fcrrooxidans и другие участвуют в растворении урана, обеспечивая образование окислителя Fe3+. Из растворов уран извлекается классическим способом с использованием ионнообменных смол.
Уранинит
Слайд 25
Переработка сложных руд и концентратов в реакторах (чановое
выщелачивание)
Процесс извлечения металлов из концентратов
с использованием бактерий и осуществляемый в специальных аппаратах называется чановым.
Концентрат измельчают до размеров частиц 40— 70 мкм, помещают в контактный чан и создают плотность пульпы от 20 до 40 % твердого вещества и перемешивают при разной температуре в зависимости от вида добавленных бактерий.
Растворы после частичной или полной регенерации используют для выщелачивания или сбрасываются в хвостохранилише.
Слайд 26
Переработка золотомышьяковых концентратов
Золото и
серебро встречаются в природе как в свободном состоянии, так
и в кристаллических решетках сульфидных минералов, главным образом в арсенопирите (FeAsS) и пирите (FeS2). Наиболее простой, эффективной и экологически чистой является комбинированная технология, включающая бактериальное окисление. Сначала из руды получают концентрат, при этом содержание золота увеличивается до 50— 120 г/т. Концентрат измельчают до размеров частиц 95%-го класса — 0,044 мм. Затем готовят пульпу раствору 1:5. И вносят сообщество бактерий A. ferrooxidans и представителей родов Sulfobacillus,Leptospirillum и Ferropiasma. Это мезофильные бактерии (t= 30’С) Для извлечения золота используется способ ионообменной смолы.
Арсенопирит
Пирит
Слайд 27
Обессеривание углей
Сера в углях присутствует
как в виде пирита, так и в виде сложных
ароматических соединений. Удаление серы с помощью A.ferrooxidans из углей за 5 —8 суток извлекается до 97 % пиритной серы. Для извлечения серы, содержащейся в органических соединениях, делаются попытки использовать гетеротрофные бактерии.
Сера
Слайд 28
Микроорганизмы как биосорбенты металлов
Сорбенты (от лат. sorbens —
поглощающий) — твердые тела или жидкости, избирательно поглощающие (сорбирующие)
из окружающей среды газы, пары или растворённые вещества.
Слайд 29
Сорбация и осаждение металлов микроорганизмами
Слайд 30
Экологические аспекты
Все технологические схемы этого способа добычи металлов
- замкнутые, поэтому в значительной мере исключают выброс растворов
в биосферу;
подземное выщелачивание исключает необходимость отвода больших участков земли под горные предприятия, при этом сохраняется ландшафт;
общим для всех гидрометаллургических предприятий отходом являются растворы, содержащие тяжелые металлы;
проблема обезвреживания твердых отходов биогидрометаллургических производств, например соединений мышьяка (арсенат железа или кальция), цианидов, роданидов и т.д.;
микроорганизмы, применяемые в биогеотехнологии для получения металлов, не патогенны и поэтому не представляют опасности для окружающей среды.
Слайд 31
МЕТОДЫ ЭКОЛОГИИ МИКРООРГАНИЗМОВ
Слайд 32
Выделение микроорганизмов из экониш и проблемы, связанные с
некультивируемыми формами
Большинство микроорганизмов, растущих в природных образцах, еще ждут
своей очереди быть выделенными в чистые культуры. По некоторым оценкам, мы можем культивировать меньше 0,1 % всего микробного разнообразия.