- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Энзиматическаябиотехнология
Содержание
- 2. ФерментыБиокатализаторы белковой природы.Особенности:НетоксичныРаботают в мягких условияхОбладают высокой специфичностью и эффективностью действияСохраняют свои свойства вне клетки
- 3. Использование ферментных препаратов в промышленностиЩелочные протеазы –
- 4. Амилолитические ферментыα-амилаза, β-амилаза, глюкоамилазаОсновная функция - гидролиз крахмала и гликогена. Применяются в спиртовой промышленности, хлебопечении.
- 5. Протеолитические ферменты (пептидгидролазы)Ускорение гидролиза пептидных связей в
- 6. Пектолитические ферментыУменьшают молекулярную массу и снижают вязкость
- 7. Целлюлолитические ферментыОчень специфичны.Действие - деполимеризации молекул целлюлозы.
- 8. Факторы, влияющие на биосинтез ферментовГенетический. Состав и
- 9. По характеру культивирования все
- 10. Глубинный метод производства ферментов Микроорганизмы выращиваются в
- 11. Этапы глубинного культивированияПриготовление питательных сред. Стерилизацию
- 12. Поверхностное культивирование продуцентовКультура растет на поверхности твердой
- 13. Схема очистки сводится к следующему: - освобождение
- 14. Недостатки чистых ферментативных препаратовВысокая стоимостьНестабильныНеобходимы специальные условия храненияОднократное использованиеТрудная очистка от субстратов и продуктов реакций
- 15. Инженерная энзимология1916 – Нельсон Дж., Гриффин Е.
- 16. ПреимуществаВысокая стабильность и долговечностьЛегко отделяются от реакционной
- 17. Требования к носителям (Дж.Порат, 1974): высокая химическая
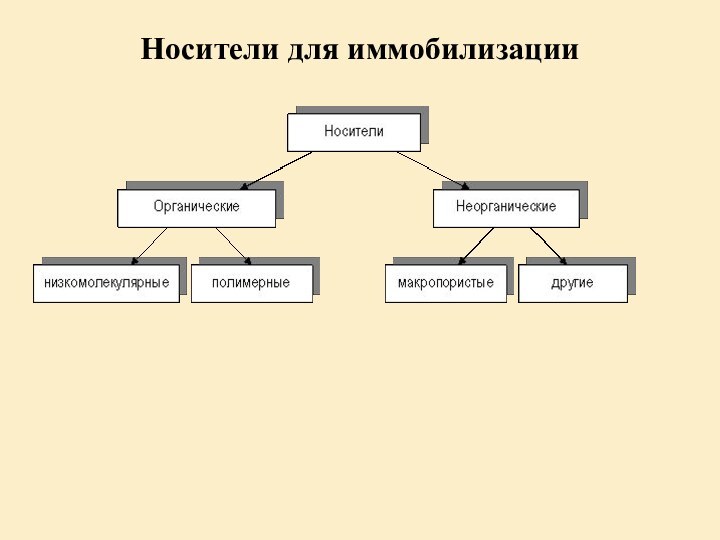
- 18. Носители для иммобилизации
- 19. Природные полимерные – белковые (кератин, фиброин, коллаген,
- 20. Методы иммобилизации ферментовФизическая иммобилизация. Включение
- 21. Типа связывания ферментовадсорбция на нерастворимых носителях (электростатические,
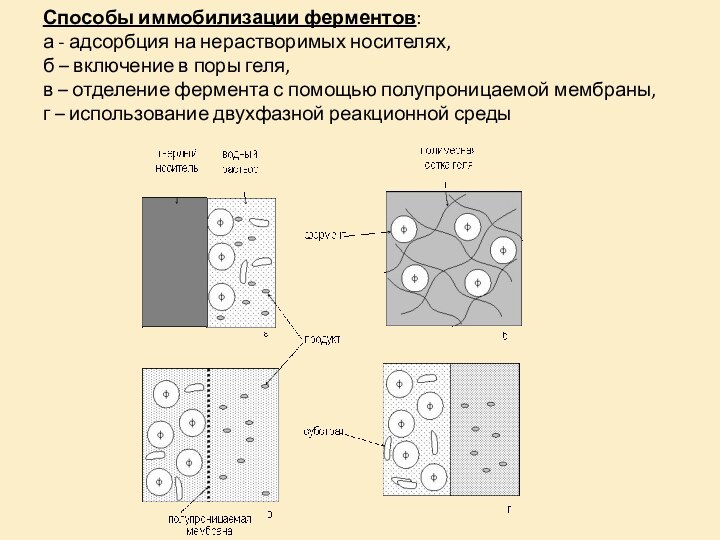
- 22. Способы иммобилизации ферментов: а - адсорбция
- 23. Химическая иммобилизацияпутем химического взаимодействия на структуру фермента
- 24. Методы химической иммобилизацииНа носителях с гидроксогруппами (бромциановый
- 25. Применение иммобилизованных ферментовМедицина - лекарственных препаратов пролонгированного
- 26. БиосенсорыАналитические устройства, в которых чувствительный слой, содержащий
- 27. Конструирование биосенсораБиохимический преобразователь (биотрансдьюсер, биоселектор) – биоэлемент
- 28. Ферментные биосенсоры – ферментные электроды (электрод с
- 30. Использование биосенсоровизмерение пищевой ценности, свежести, безопасности продуктов
- 31. Биочипы1975 – саузерн-блотт Саузерна Э. (меченая НК
- 32. Применение биочиповПоиск и установление функций генов,Диагностика заболеваний,Проверка
- 33. Скачать презентацию
- 34. Похожие презентации
ФерментыБиокатализаторы белковой природы.Особенности:НетоксичныРаботают в мягких условияхОбладают высокой специфичностью и эффективностью действияСохраняют свои свойства вне клетки






























Слайд 2
Ферменты
Биокатализаторы белковой природы.
Особенности:
Нетоксичны
Работают в мягких условиях
Обладают высокой специфичностью
и эффективностью действия
Слайд 3
Использование ферментных препаратов в промышленности
Щелочные протеазы – 25
%
Реннины – 10 %
Трипсины – 3 %
Амилазы – 18
%Целлюлазы, лактазы – 1 %
Изомеразы – 6 %
Пектиназы – 3 %
Липазы – 3 %
Мармацея – 10 %
Другие – 21 %
Слайд 4
Амилолитические ферменты
α-амилаза, β-амилаза, глюкоамилаза
Основная функция - гидролиз крахмала
и гликогена.
Применяются в спиртовой промышленности, хлебопечении.
Слайд 5
Протеолитические ферменты (пептидгидролазы)
Ускорение гидролиза пептидных связей в белках
и пептидах.
Особенность - селективный характер действия на пептидные
связи в белковой молекуле. Пример, пепсин действует только на связь с ароматическими аминокислотами, трипсин - на связь между аргинином и лизином.
В промышленности протеазы классифицируют по способности проявлять активность в определенной области рН:
рН 1.5-3.7 - кислые; рН 6.5-7.5 - протеазы; pH>8.0 - щелочные.
Применение:
- мясная - для смягчения мяса;
- кожевенная - смягчение шкур;
- кинопроизводство - растворение желатинового слоя при регенерации пленок;
- парфюмерная - добавки в зубную пасту, кремы, лосьоны;
- производство моющих средств - добавки для удаления загрязнений белковой природы;
- медицина - при лечении воспалительных процессов, тромбозов.
Слайд 6
Пектолитические ферменты
Уменьшают молекулярную массу и снижают вязкость пектиновых
веществ.
Делятся на две группы - гидролазы и трансэлиминазы.
Гидралазы отщепляют метильные остатки или разрывают гликозидные связи.
Трансэлиминазы ускоряют негидролитическое расщепление пектиновых веществ с образованием двойных связей.
Применяются в текстильной промышленности (вымачивание льна перед переработкой), в виноделии - осветление вин, при консервировании фруктовых соков.
Слайд 7
Целлюлолитические ферменты
Очень специфичны.
Действие - деполимеризации молекул целлюлозы.
В
медицинской промышленности используют для выделения стероидов из растений, в
пищевой - для улучшения качества растительных масел, в сельском хозяйстве - как добавки в комбикорма для жвачных животных.
Слайд 8
Факторы, влияющие на биосинтез ферментов
Генетический. Состав и количество
синтезируемых ферментов наследственно детерминированы.
Состав питательной среды. Наличие источников
основных питательных веществ и веществ, играющих роль индукторов или репрессоров биосинтеза данного конкретного фермента или их групп:факторы роста: аминокислоты, пуриновые основания и их производные, РНК и продукты её гидролиза;
источник углерода - крахмал, кукурузный экстракт, соевая мука, гидролизаты биомассы дрожжей;
минеральные источники азота;
ионы Mg, Mn, Zn, Fe, Cu и др. металлов;
Слайд 9 По характеру культивирования все технологические
процессы производства ферментных препаратов делятся на две большие группы:
глубинный и поверхностный методы.
Слайд 10
Глубинный метод производства ферментов
Микроорганизмы выращиваются в жидкой питательной
среде.
Легко поддается автоматизации и механизации.
Концентрация фермента в
среде ниже. .
Слайд 11
Этапы глубинного культивирования
Приготовление питательных сред.
Стерилизацию среды проводят
путем микрофильтрации с помощью мембран, или при помощи высоких
температур. Воздух очищается до и после аэрирования.Получение засевного материала.
Для грибов - мицелиальная вегетативная масса, для бактерий - молодая растущая культура на начальной стадии спорообразования.
Объем посевного материала зависит от физиологических особенностей продуцента.
Производственное культивирование.
Биосинтез протекает в течение 2-4 суток при непрерывной подаче воздуха и перемешивании. Температурный оптимум 22-32оС.
Выделение.
В мицелии трёхсуточной культуры обычно остается не более 15% ферментов. Остальные выделяются в окружающую клетки жидкую среду. В этом случае препараты ферментов выделяют из фильтратов после отделения биомассы.
5. Получение товарной формы
Слайд 12
Поверхностное культивирование продуцентов
Культура растет на поверхности твердой увлажненной
питательной среды.
Среда должна быть рыхлой, а слой культуры-продуцента
небольшим. Выращивание производственной культуры происходит в асептических условиях.
Преимущества поверхностной культуры: значительно более высокая конечная концентрация фермента на единицу массу среды, легко высушивается, легко переводится в товарную форму.
Посевной материал может быть трёх видов: культура, выросшая на твердой питательной среде; споровый материал; мицелиальная культура, выращенная глубинным способом.
Основу питательной среды составляют пшеничные отруби. Для повышения активности ферментов можно добавлять свекловичный жом, соевый шрот, крахмал, растительные отходы.
Стерилизуют среду паром при помешивании (температура - 105-140 С, время 60-90 минут). После этого среду засевают и раскладывают ровным слоем в стерильных кюветах в растильных камерах. Культивируют в течение 36-48 часов.
Слайд 13
Схема очистки сводится к следующему:
- освобождение от
нерастворимых веществ;
- освобождение от сопутствующих растворимых веществ;
-
фракционирование (как правило, хроматографическими методами). Для выделения фермента из поверхностной культуры необходима экстракция. Как правило, экстраген - вода.
Стадию выделения и очистки завершает сушка. После сушки препарат должен содержать не более 6-8% влаги, тогда он может в герметичной упаковке храниться до года без потери активности.
Стандартизация ферментного препарата - доводка активности фермента до стандартной, соответствующей требованиям ГОСТ. Для этого используются различные нейтральные наполнители - крахмал, лактоза и др.
Слайд 14
Недостатки чистых ферментативных препаратов
Высокая стоимость
Нестабильны
Необходимы специальные условия хранения
Однократное
использование
Трудная очистка от субстратов и продуктов реакций
Слайд 15
Инженерная энзимология
1916 – Нельсон Дж., Гриффин Е. –
сахараза на угле
1939 – первый патент – протеазы на
опилках для обработки шкур1960-е – появление науки
1971 - термин «иммобилизованные ферменты»
Иммобилизация — технология, согласно которой фермент закрепляют на носителе.
Иммобилизованные ферменты – ферменты, выделенные из клетки, искусственно закрепленные на носителе и сохраняющие свойственную им каталитическую активность.
Слайд 16
Преимущества
Высокая стабильность и долговечность
Легко отделяются от реакционной среды
Многократное
использование
Технологичны
Подбирая носители и методы иммобилизации можно изменять свойства ферментов
Слайд 17
Требования к носителям (Дж.Порат, 1974):
высокая химическая и
биологическая стойкость;
высокая химическая прочность;
достаточная проницаемость для фермента
и субстратов, пористость, большая удельная поверхность; возможность получения в виде удобных в технологическом отношении форм (гранул, мембран);
легкая активация;
высокая гидрофильность;
невысокая стоимость.
Слайд 19 Природные полимерные – белковые (кератин, фиброин, коллаген, желатин),
полисахаридные (целлюлоза, декстран, агароза, альгинаты; хитин, хитозан), липидные.
Синтетические полимерные
– полиметиленовые, полиамидные, полиэфирные.Неорганической природы – глина, стекло, керамика, селикагель, графитовая сажа, оксиды металлов.
Слайд 20
Методы иммобилизации ферментов
Физическая иммобилизация.
Включение
фермента в такую среду, в которой для него доступной
является лишь ограниченная часть общего объема.При физической иммобилизации фермент не связан с носителем ковалентными связями.
Слайд 21
Типа связывания ферментов
адсорбция на нерастворимых носителях (электростатические, гидрофобные,
дисперсионные взаимодействия или водородные связи);
включение в поры геля
(равномерное распределение фермента в носителе; для водорастворимых субстратов); пространственное отделение фермента от остального объема реакционной системы с помощью полупроницаемой мембраны (в медицине и науке);
включение в двухфазную среду, где фермент растворим и может находиться только в одной из фаз.
Слайд 22 Способы иммобилизации ферментов: а - адсорбция на нерастворимых
носителях, б – включение в поры геля, в –
отделение фермента с помощью полупроницаемой мембраны, г – использование двухфазной реакционной среды
Слайд 23
Химическая иммобилизация
путем химического взаимодействия на структуру фермента в
его молекуле создаются новые ковалентные связи, в частности между
белком и носителем.Достоинства препаратов:
- высокую прочность образующегося конъюгата;
- химическая модификация способна приводить к существенным изменениям их свойств, таких как субстратная специфичность, каталитическая активность и стабильность.
Слайд 24
Методы химической иммобилизации
На носителях с гидроксогруппами (бромциановый метод)
На
носителях с аминогруппами (аминогуппы превращаются в соли диазония)
На носителях
с сульфгидрильными группами (образование дисульфидных связей на воздухе)
Слайд 25
Применение иммобилизованных ферментов
Медицина - лекарственных препаратов пролонгированного действия
со сниженной токсичностью и аллергенностью. Направленный транспорт лекарств в
организме.Фотолиз воды и в биоэлектрокатализ.
Переработка лигноцеллюлозного сырья.
Усилители слабых сигналов. На этой основе были созданы механо- и звукочувствительные датчики и открыт путь к бессеребряной фотографии.
Пищевая промышленность - получение глюкозо-фруктовых сиропов, глюкозы, яблочной и аспарагиновой кислоты, оптически активных L- аминокислот, диетического безлактозного молока, сахаров из молочной сыворотки и др.
Перфузионная очистка биологических жидкостей.
Стиральные и моющие средства, в дубильных процессах.
Слайд 26
Биосенсоры
Аналитические устройства, в которых чувствительный слой, содержащий биологический
материал, реагирует на присутствие определяемого компонента и генерирует электрический
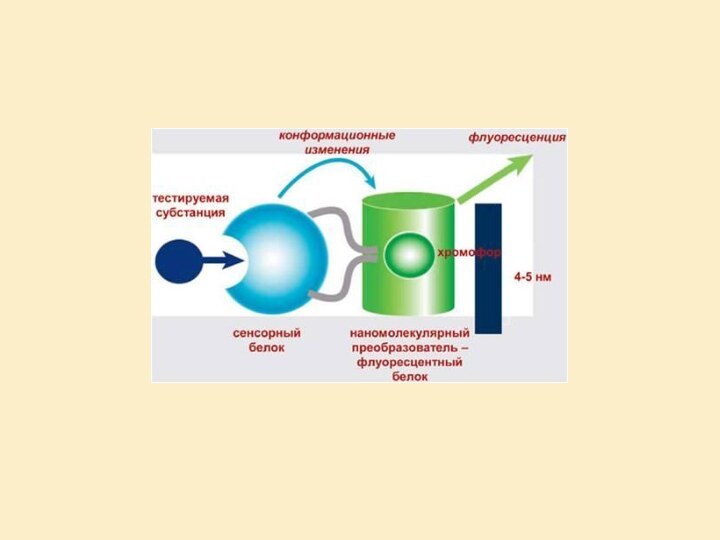
сигнал, функционально связанный с наличием и концентрацией этого вещества.Биоматериал – ферменты, бактерии, ткани, дрожжи, антитела, антигены, липосомы, органеллы, рецепторы, ДНК.
1967 – Кларк Л. – использование ферментного электрода, Лионе К.
Слайд 27
Конструирование биосенсора
Биохимический преобразователь (биотрансдьюсер, биоселектор) – биоэлемент распознавания,
преобразует информацию о химсвязях в физический или химический сигнал.
Физический
преобразователь (трансдьюсер) – преобразует сигнал в электрический с помощью спецаппаратуры.Виды: электрохимические, спектроскопические, термические, пьезоэлектрические, оптические, гравитационные, резонансные.
Слайд 28 Ферментные биосенсоры – ферментные электроды (электрод с нанесенным
природным полимером, содержащим иммобилизованные ферменты), микрокалориметрические датчики (из 2
колонок, заполненных имм. ферментом и термисторов – регистрация теплового эффекта хим.реакции в 1-й колонке), биодатчики на основе биолюминесценции (колонка и светоприемное устройство).Использование - определение сахара в крови, содержания пенициллина в среде, оценка глубины инфаркта миокарда.
Клеточные биосенсоры – включение клеток микроорганизмов в носители.
Использование – генодиагностика.
Слайд 30
Использование биосенсоров
измерение пищевой ценности, свежести, безопасности продуктов питания;
экспресс-анализ
крови;
обнаружение и измерение;
степени загрязнения окружающей среды;
детекция и определение
количества взрывчатых веществ, токсинов и биологического оружия;извлечение металлов из сточных вод;
изготовление водородных солнечных элементов;
Очистка природных и сточных вод.
Слайд 31
Биочипы
1975 – саузерн-блотт Саузерна Э. (меченая НК для
определения последовательности фрагментов ДНК).
1980-е – Россия- начало исследований.
Биочип –
устройство, объединяющее сенсор, трансдьюсер, аналогово-цифровой преобразователь и микропроцессор.Виды: матричные (ДНК), микрофлюидные (капиллярные), с использованием микросфер с цветовой кодировкой.
Размер ячейки – 50-200микрон, число ячеек – 1000-100000, анализируемые концентрации – 10 мкМ, размер – 1 см.
Слайд 32
Применение биочипов
Поиск и установление функций генов,
Диагностика заболеваний,
Проверка действия
лекарств,
Диагностика отторжения при трансплантации,
Контроль за патогенными организмами,
Обнаружение жизни во
Вселенной.Днк-микрочипы: идентификация мутаций, наблюдение за активностью генов, диагностика инфекционных заболеваний, скрининг микрорганизмов,
Белковые биочипы: оценки эффективности лекарственных препаратов, изучение взаимодействия белков.