Слайд 2
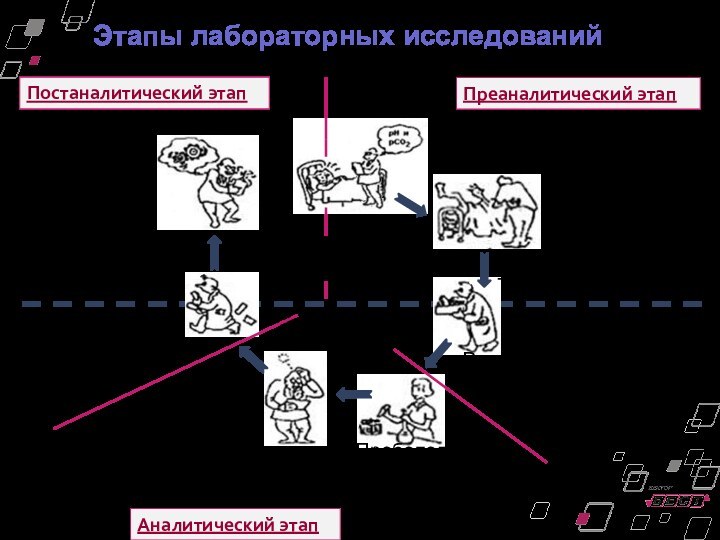
Этапы лабораторных исследований
Назначение анализа
Забор материала
Транспортировка
Передача результатов
Постановка
диагноза
Пробоподготовка и
выполнение исследования
Интерпретация результатов
Вне лаборатории
Внутри лаборатории
Регистрация проб, предобработка, хранение
Преаналитический этап
Аналитический
этап
Постаналитический этап
Слайд 3
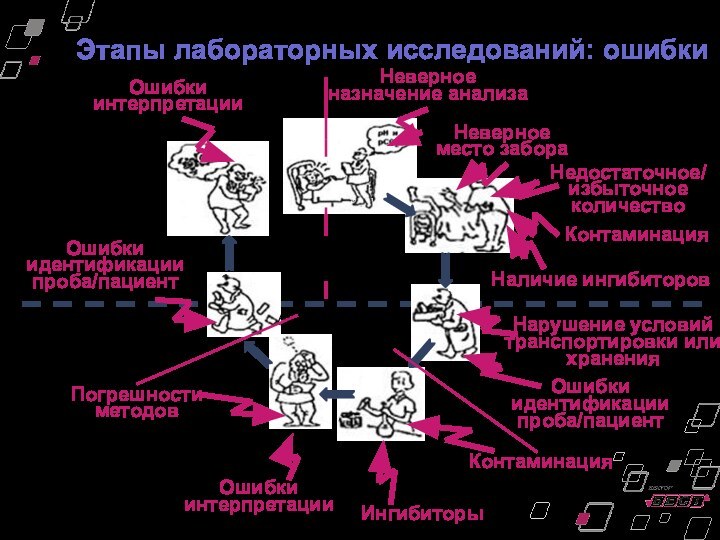
Этапы лабораторных исследований: ошибки
Вне лаборатории
Внутри лаборатории
Слайд 4
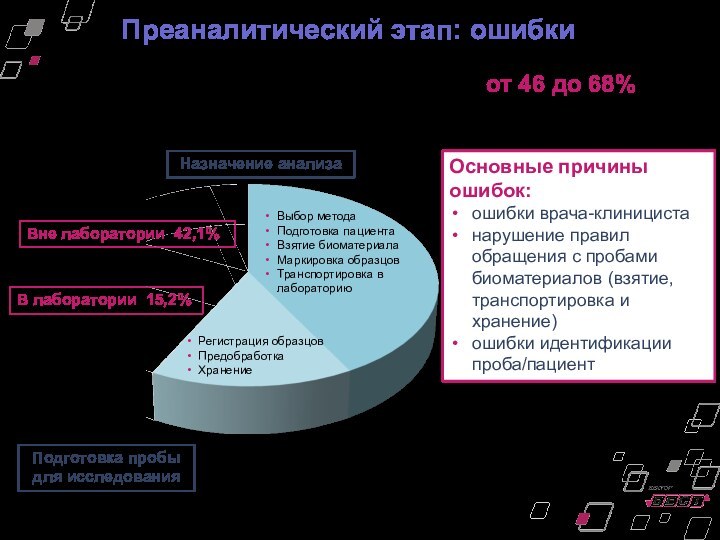
Преаналитический этап: ошибки
На преаналитический этап приходится от 46
до 68% всех лабораторных ошибок.
Вне лаборатории 42,1%
В лаборатории
15,2%
Выбор метода
Подготовка пациента
Взятие биоматериала
Маркировка образцов
Транспортировка в лабораторию
Регистрация образцов
Предобработка
Хранение
Назначение анализа
Подготовка пробы для исследования
Основные причины ошибок:
ошибки врача-клинициста
нарушение правил обращения с пробами биоматериалов (взятие, транспортировка и хранение)
ошибки идентификации проба/пациент
Слайд 5
Преаналитический этап: качество
Какие факторы могут повлиять на качество
исследования?
Подготовка пациента
Время суток забора материала
Диета
Положение тела при заборе материала
Выбор
места забора материала
Процедура взятия материала
Антикоагулянт
Система для проведения забора материала
Техника взятия материала
Транспортировка материала
Температурный режим
Время транспортировки
Наличие контейнеров для транспортировки
Срок хранения перед аналитической процедурой
Слайд 6
Преаналитический этап: нарушение правил обращения с пробами
Нарушение
правил взятия, транспортировки, хранения
Перекрёстная контаминация
Разрушение аналита
Ложно «+»
результат
Ложно «-»
результат
Неверный диагноз
Повторные
исследования
Слайд 7
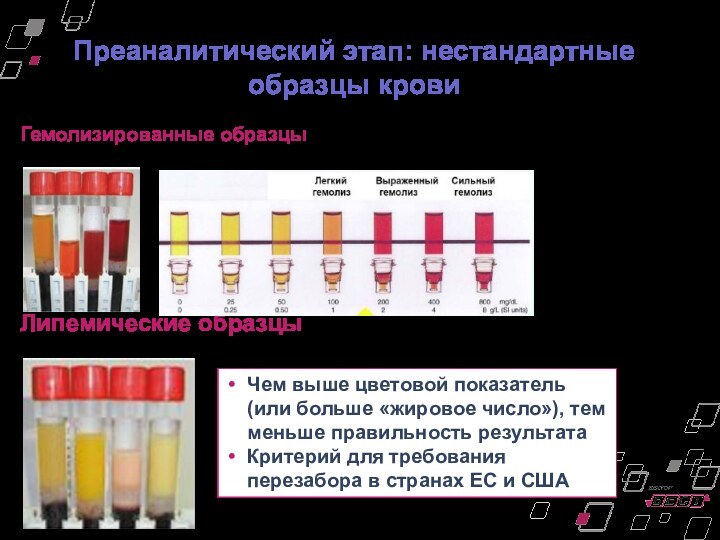
Преаналитический этап: нестандартные образцы крови
Гемолизированные образцы
Липемические образцы
Чем выше
цветовой показатель (или больше «жировое число»), тем меньше правильность
результата
Критерий для требования перезабора в странах ЕС и США
Слайд 8
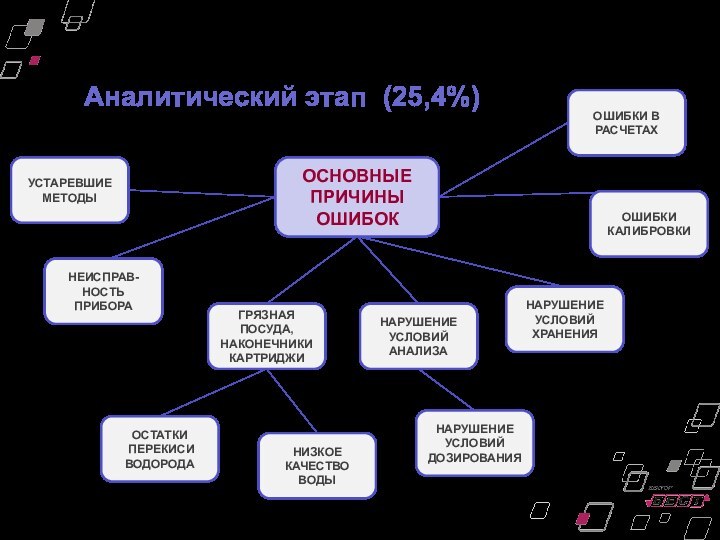
Аналитический этап
(25,4%)
ОСНОВНЫЕ
ПРИЧИНЫ
ОШИБОК
ГРЯЗНАЯ ПОСУДА,
НАКОНЕЧНИКИ
КАРТРИДЖИ
НЕИСПРАВ-НОСТЬ
ПРИБОРА
УСТАРЕВШИЕ МЕТОДЫ
НАРУШЕНИЕ
УСЛОВИЙ
ХРАНЕНИЯ
НАРУШЕНИЕ
УСЛОВИЙ АНАЛИЗА
НАРУШЕНИЕ УСЛОВИЙ ДОЗИРОВАНИЯ
НИЗКОЕ
КАЧЕСТВО ВОДЫ
ОСТАТКИ
ПЕРЕКИСИ
ВОДОРОДА
ОШИБКИ
В РАСЧЕТАХ
ОШИБКИ КАЛИБРОВКИ
Слайд 9
Факторы, влияющие на результаты исследований:
Постаналитический этап
- раса
- пол
-
возраст
- характер питания
- курение/алкоголь/кофе
- беременность
- стресс (страх)
- положение человека
при взятии крови
и т.д.
- прием лекарственных средств
проверка лабораторным специалистом результата анализа на предмет его аналитической достоверности и биологической вероятности;
оценка лечащим врачом клинической значимости информации о состоянии пациента
(17,4%)
Слайд 10
Сопоставление качества определения активности АЛТ методами Р-Ф и
IFCC (по правильности)
K – коэффициент межлабораторной вариации
N –
доля неудовлетворительных результатов, %
Устаревшие методы
НЕОБХОДИМО!
Использовать
для работы современные методы анализа
Слайд 11
Дистиллированная вода
( ГОСТ 6709-72)
Вода для лабораторного
анализа
ГОСТ Р 52501-2005; ИСО 3696:1987
Низкое качество воды
дистиллированная
(3 класс очистки)
бидистиллированная (2 класс очистки)
деионизованная (1 класс очистки)
рН –
5,4-6,6
Удельная электропроводность –
не более 0,5 (0,1) мСм/м при 20 °С
Масса сухого остатка после выпаривания –
не более 5 (1) мг/л
Слайд 12
Дистиллированная вода
( ГОСТ 6709-72)
Вода для лабораторного
анализа
ГОСТ Р 52501-2005; ИСО 3696:1987
Низкое качество воды
НЕОБХОДИМО !
Регулярно чистить дистиллятор от накипи, ржавчины и биозагрязнений.
Регулярно проверять качество воды на соответствие ГОСТ.
Тщательно 1 раз в неделю промывать сборники воды (в том числе анализаторов).
Для хранения и отбора воды пользоваться только химически чистой посудой.
Не хранить воду более 2-3 дней.
Не хранить воду в металлической посуде.
Слайд 13
Химические загрязнения
Посуда для анализа должна быть химически чистой!
НЕОБХОДИМО!
Использовать моющие средства без биодобавок (протеаз).
Не использовать для
дезинфекции перекись водорода.
Картриджи для автоматических анализаторов мыть и периодически заменять на новые.
Для калибровки использовать новые наконечники и чашки образца.
Стеклянные пробирки при определении электролитов необходимо обрабатывать соляной кислотой, а лучше использовать одноразовые пластиковые пробирки.
Использовать ультразвуковую мойку для мытья картриджей, наконечников и т.д.
Посуда может не иметь видимых признаков загрязнений, тем не менее, на ее поверхности, если она недостаточно хорошо вымыта, могут оставаться различные вещества. Этими веществами могут быть белки (в том числе и ферменты-протеазы), красители, молекулы перекиси водорода и т.д.
Слайд 14
Влияние паров дезрастворов на результат ИФА
Контрольный планшет
Спирт, хлоргексидин,
велтолен
Перекись водорода
Слайд 15
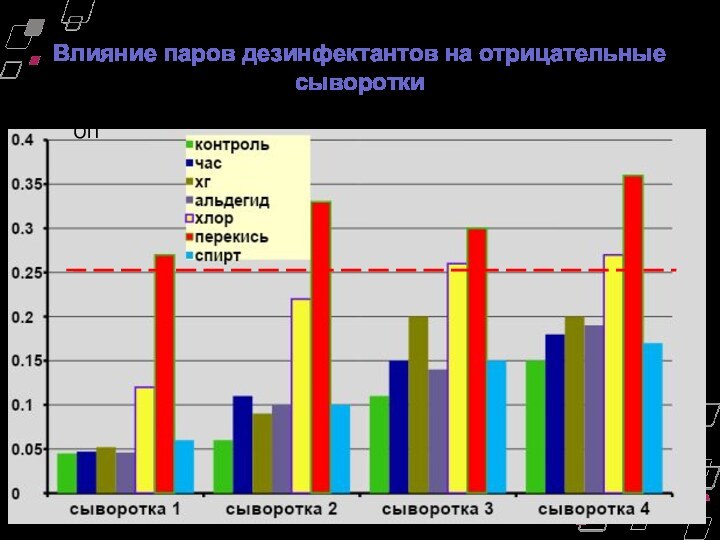
Влияние паров дезинфектантов на отрицательные сыворотки
ОП
Слайд 16
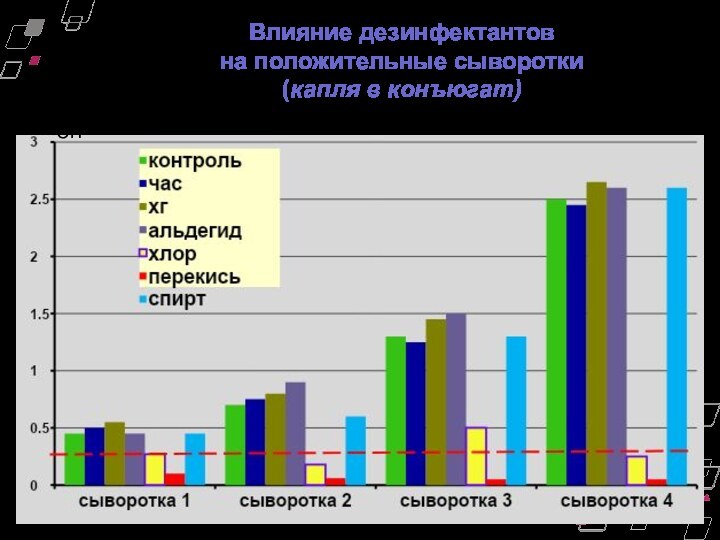
Влияние дезинфектантов
на положительные сыворотки
(капля в конъюгат)
ОП
Слайд 17
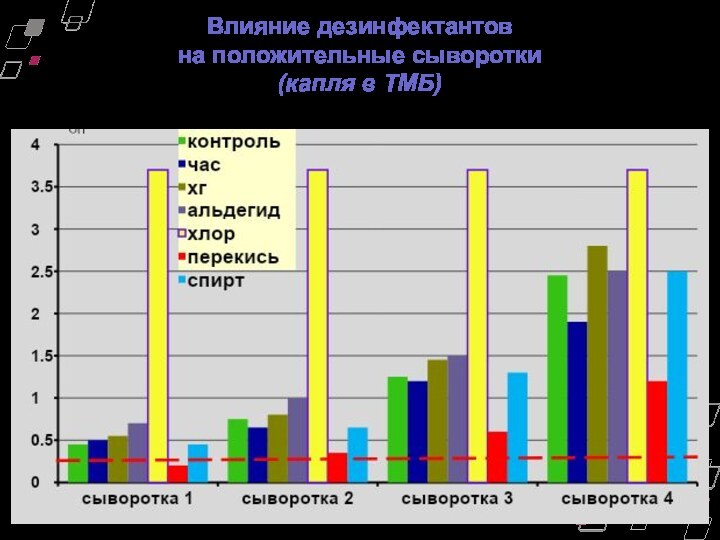
Влияние дезинфектантов
на положительные сыворотки
(капля в ТМБ)
Слайд 19
Основные характеристики различных групп дезинфицирующих средств
Т.Я.Пхакадзе Центральный
институт травматологии и ортопедии им. Н.Н.Приорова, Москва, Россия
Клиническая микробиология
и антимикробная химиотерапия. №1, Том 4, 2002
Слайд 20
Типы дезинфицирующих средств
(по химическому составу)
Хлорсодержащие препараты (Деохлор,
Жавелион, Хлорамин)
Препараты на основе фенола (Лизол А, Лизол Б)
Кислородсодержащие
препараты (Пергидроль)
Спиртсодержащие препараты (Аэродезин , Микроцид)
Альдегидсодержащие препараты (Бриллиант, Лизафин)
Препараты на основе ЧАС (ПАВ) (Ника-2, Ника-Экстра М, Сурфаниос, Терралин, Дезэфект, Аламинол, Велтолен, Деконекс, Вапусан 2000 )
Препараты, содержащие гуанидин (Дез-Яхонт, Демос, Дезин, Лизетол АФ)
Препараты на основе третичных аминов (Триацид, Алмироль, Мистраль, Дезолон, Амиксан.)
Слайд 21
Нарушение температурного режима хранения
Температура хранения наборов 2-8°С,
для некоторых 18-25°С.
Замораживание
Многие вещества, входящие в состав наборов,
разрушаются при замораживании/оттаивании.
Воздействие на реагент света
Свет инициирует некоторые химические реакции и реагент разрушается.
Загрязнение реагентов при вскрытии флаконов
Контаминация, пыль, биозагрязнения и др. неблагоприятно сказываются на стабильность реагентов.
Нарушение герметичности флаконов
Кислород и углекислый газ воздуха могут вступать в реакцию с компонентами реагента, т.о. разрушать его.
Нарушение условий хранения наборов
НЕОБХОДИМО !
Четко соблюдать условия хранения наборов.
Не использовать наборы с истекшим сроком годности.
Не использовать рабочие реагенты с истекшим сроком хранения.
Если набор не работает – обратиться к производителю.
Слайд 22
Грязные, поврежденные кюветы
Загрязнение и другие дефекты светофильтров
Нарушена юстировка
лампы
Ресурс лампы исчерпан
Нестабильность напряжения в электросети
Нарушение условий термостатирования
Нарушение условий
дозирования и т.д.
Неисправность прибора
НЕОБХОДИМО!
Регулярно проводить техническое обслуживание прибора
Регулярно тщательно мыть кюветы чистящими растворами
Слайд 23
Закон Российской Федерации
«Об обеспечении единства измерений»
от
27 апреля 1993 г
Статья 13. Государственный метрологический контроль и
надзор, осуществляемые с целью проверки соблюдения метрологических правил и норм, распространяется на здравоохранение.
Поверка средств измерений – совокупность операций, выполняемых органами государственной метрологической службы (другими уполномоченными на то органами, организациями) с целью определения и подтверждения соответствия средств измерений установленным техническим требованиям.
По результатам поверки выдается на 1 год свидетельство о поверке средств измерений.
Слайд 24
Средства измерения, подлежащие метрологической поверке
Спектрофотометр (набором эталонных фильтров
с различной оптической плотностью).
Дозаторы(гравиметрическим способом, взвешивая дистиллированную воду
10%, 50%, 100% от полного объема шкалы пипетки).
Термометры (относительно эталонного термометра).
Слайд 25
Контроль работы планшетного спектрофотометра
Взять 0,5 М серную кислоту
(стоп-реагент)
разлить по 200 мкл во все лунки планшета
(планшет предварительно должен быть промыт р-ром ФСБ-Т);
измерить оптическую плотность на 450 нм относительно воздуха;
ОП не должна превышать 0,05.
Слайд 27
Проверка работоспособности биохимического фотометра
Проверка холостой пробы
Проверка воспроизводимости
Проверка на тестах с λ340
«Креатининовый тест»
Проверка на другой кювете
Слайд 28
Контроль работы
автоматических дозаторов
Необходимы метрологическим путем
поверенные весы и разновесы.
Выставить дозатор на объём 50 %
от полного объёма шкалы дозатора(или наиболее часто используемый объём).
Отобрать соответствующее количество дистиллированной воды.
Вылить воду в сухую, предварительно взвешенную, пробирку и сделать повторное взвешивание.
1 мкл – 1 мг
Слайд 29
Термостат
Необходимо в термостате на полке иметь термометр (поверенный)
.
В термостатах без вентилирования температура в разных зонах камеры
может существенно различаться.
В современных термостатах, как правило, есть вентилятор создающий равномерность температуры по всему объему.
Слайд 30
Автоматические вошеры
и ручные гребёнки
Необходимо следить за состоянием
каналов; их засорение приводит к снижению эффективности отмывки.
Требуется ежедневная промывка системы дистиллированной водой (не оставляйте вошер заполненным промывочным раствором на ночь).
Наличие микробиологических заростов в шлангах, каналах, ёмкостях уменьшает специфичность анализа.
Обязательно, как минимум, раз в неделю промывать всю систему вошера 70% спиртом или другим раствором, рекомендованным инструкцией к прибору.
Проводить дезинфекцию вошера (Lysotol, Aseptisol)
Слайд 31
Нарушение условий дозирования
Подходит для обычных жидкостей
Для растворителей (обязательна
предварительная промывка)
Биологические жидкости
Для пенящихся и вязких жидкостей
Слайд 32
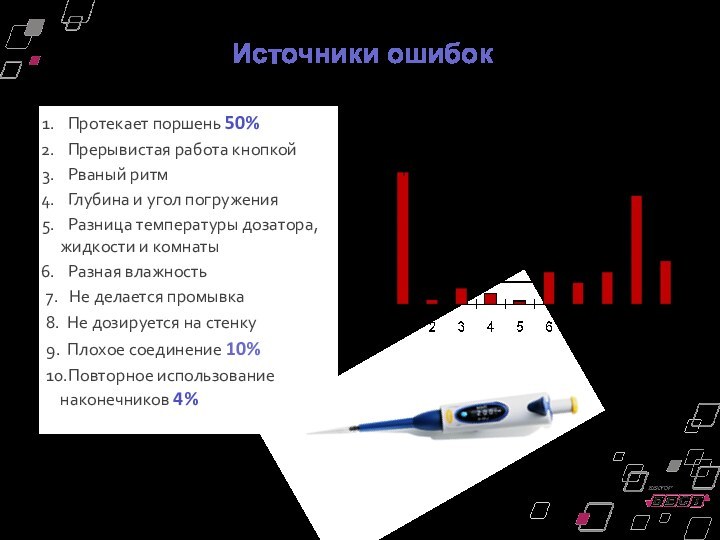
Источники ошибок
Протекает поршень 50%
Прерывистая работа кнопкой
Рваный ритм
Глубина и угол погружения
Разница температуры дозатора,
жидкости и комнаты
Разная влажность
7. Не делается промывка
8. Не дозируется на стенку
9. Плохое соединение 10%
10.Повторное использование наконечников 4%
Слайд 34
Полученные результаты значительно отличаются от аттестованных в контрольной
сыворотке
НЕПРАВИЛЬНО ВЫБРАН МЕТОД В КОНТРОЛЬНОЙ СЫВОРОТКЕ ИЛИ МУЛЬТИКАЛИБРАТОРЕ
Амилазы: IFCC,
37°С, субстрат EPS, субстрат CNPG3
ЛДГ: SFBC, DGKC, IFCC
Холинэстераза: DGKC 1994, DGKC 1970
Определение активности ферментов
НЕОБХОДИМО!
Правильно выбрать метод в контрольном материале и калибровочном образце.
Слайд 35
Полученные результаты незначительно (возможно, до 2s) отличаются от
аттесто-ванных в контрольном материале, при этом контрольные сыворотки нормального
и патологического уровней отклоняются от среднего значения в одну сторону
НЕ ОТКОРРЕКТИРОВАН ФАКТОР
F
НЕОБХОДИМО!
Откорректировать фактор по сывороточному мультикалибратору.
Слайд 36
Перед началом реакции температуру
рабочего реагента необходимо довести
до
температуры анализа, указанной
в инструкции, и обеспечить её
поддержание
в течение всего времени
анализа с точностью ±0,1°С.
Температура
Определение общего белка в сыворотке крови:
«…пробы перемешать, выдержать 15 минут при комнатной температуре (18-25°С) или 10 минут при 37°С…»
Определение HBsAg:
«…9.3. Инкубировать в термостатируемом шейкере с интенсивностью перемешивания 700–800 об/мин: 40 мин при 42°С или 60 мин при 37°С….»
Слайд 37
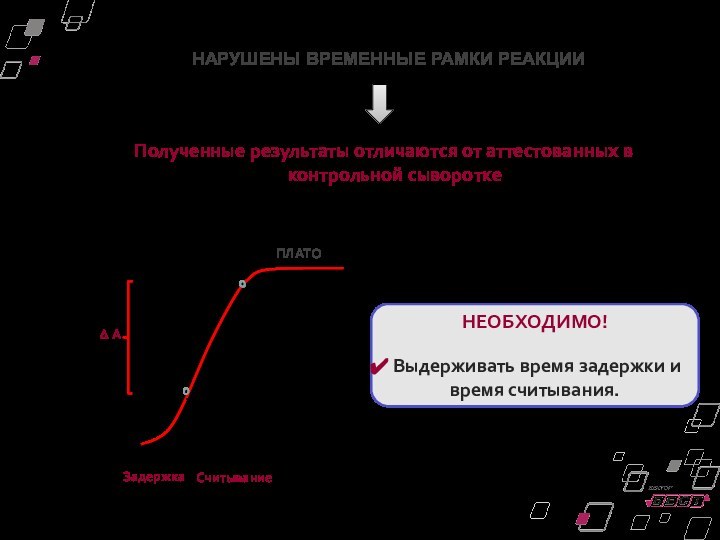
Полученные результаты отличаются от аттестованных в контрольной сыворотке
НАРУШЕНЫ
ВРЕМЕННЫЕ РАМКИ РЕАКЦИИ
ПЛАТО
…………
НЕОБХОДИМО!
Выдерживать время задержки и время считывания.
Слайд 38
НАРУШЕНЫ УСЛОВИЯ ХРАНЕНИЯ НАБОРА ИЛИ РАБОЧЕГО РЕАГЕНТА
Признаки:
Неправильные, заниженные результаты анализа, высокая оптическая плотность рабочего реагента
(более 0,8) при 405 нм (ЩФ, γ-ГТ) или низкая оптическая плотность рабочего реагента (менее 1,0) при 340 нм для (АЛТ, АСТ, ЛДГ, ГБДГ).
Причины: разрушение субстрата или НАДН в реагенте, вследствие хранения реагента под воздействием температуры или света, в результате его загрязнения.
НЕОБХОДИМО!
Строго соблюдать условия хранения, изложенные в инструкции к набору.
ТЕМПЕРАТУРА
СВЕТ
ЧИСТОТА
ГЕРМЕТИЧНОСТЬ
СРОК ХРАНЕНИЯ
Слайд 39
АКТИВНОСТЬ ФЕРМЕНТА СУЩЕСТВЕННО ВЫШЕ , ЧЕМ ЛИНЕЙНАЯ ОБЛАСТЬ
ОПРЕДЕЛЕНИЯ НАБОРА («ХУК-ЭФФЕКТ»)
Признаки: - Заниженные результаты анализа,
не соответствуют клинической
картине
Полученные значения не превышают 3-4 Е/л.
Причины: активность фермента существенно выходит за пределы линейной области определения.
кинетические методы
Слайд 40
Определение АЛТ (УФ-метод)
Кинетические методы
НЕОБХОДИМО!
Учитывать предел линейности набора.
Отклонение от линейности.
Верхний/нижний предел абсорбции реагента (Absorbance limit).
Если концентрация аналита
превышает верхнюю границу
линейности набора, пробу необходимо разбавить в соответствии с инструкцией.
Слайд 41
КОНТАМИНАЦИЯ
Признаки: пожелтение реагента (от бледно-желтого на начальных стадиях,
до ярко-желтого – при полном разрушении реагента).
Причины: α-Амилаза в
большом количестве содержится в слюне и поте человека, не аккуратное обращение с реагентом ведет к его загрязнению экзогенной α-амилазой, которая гидролизует субстрат.
кинетические методы
НЕОБХОДИМО!
Не допускать попадание в реагент экзогенной α-амилазы.
Слайд 42
ВОЗДЕЙСТВИЕ СВЕТА НА ОБРАЗЦЫ
Признаки: неправильные результаты анализа.
Причины: билирубин
разрушается под действием света в цельной крови, в сыворотке
и плазме, контрольных материалах (в том числе и лиофилизированных).
НЕОБХОДИМО!
Не допускать длительного воздействия света на образцы (включая контрольные материалы и калибровочные образцы).
Слайд 43
НАРУШЕНИЕ ВРЕМЕННОГО РЕЖИМА
Признаки: занижение результатов анализа.
Причины: несоблюдение времени
задержки.
ПЛАТО
…………
НЕОБХОДИМО!
Выдерживать время задержки и время считывания.
Слайд 44
РАЗРУШЕНИЕ РЕАГЕНТОВ ИЛИ РАБОЧЕГО РЕАГЕНТА
Признаки: завышенные результаты анализа,
иногда более чем в 10 раз.
Причины: - нарушение герметичности
набора,
- нарушение светового режима
- загрязнение
- истечение срока хранения.
НЕОБХОДИМО!
Строго соблюдать условия хранения рабочего реагента, изложенные в инструкции к набору.
Слайд 45
ОСТАТКИ ПЕРЕКИСИ ВОДОРОДА НА ПОСУДЕ
Признаки: - завышение результатов
анализа,
- ухудшение воспроизводимости результатов анализа,
- сокращение срока
хранения вскрытого реагента.
Причины: обеззараживание посуды проводится с помощью перекиси водорода.
Слайд 46
ЧИСТОТА ПОСУДЫ
Признаки: - ухудшение воспроизводимости результатов анализа,
- завышение
результатов анализа.
Причины: - использование необработанной стеклянной посуды,
- некачественная вода,
-
хранение воды в металлической эмалированной посуде,
- некачественно отмытая посуда для анализа.
НЕОБХОДИМО!
Тщательно отмывать посуду от моющих и дезинфицирующих средств.
Обрабатывать стеклянную посуду в соответствии с инструкцией к набору или использовать пластиковую посуду.
Следить за качеством воды
Слайд 47
ХРАНЕНИЕ РЕАГЕНТА НА БОРТУ АНАЛИЗАТОРА
(метод с ксилидиловым голубым)
Признаки:
занижение результатов анализа.
Причины: изменение рН реагента, его разрушение при
длительном взаимодействии с воздухом.
НЕОБХОДИМО!
Не допускать длительного контакта реагента с воздухом.
В случае необходимости проводить перекалибровку.
Слайд 48
- попадание из внешней среды в анализируемый образец
/реакционную пробирку , веществ/организмов приводящее к получению ложноположительных или
ложноотрицательных результатов исследования
Контаминация
(лат. contaminatio — смешение) - загрязнение образца посторонними веществами, заражение культуры микроорганизмов или живой ткани чужеродным биологическим материалом
Слайд 50
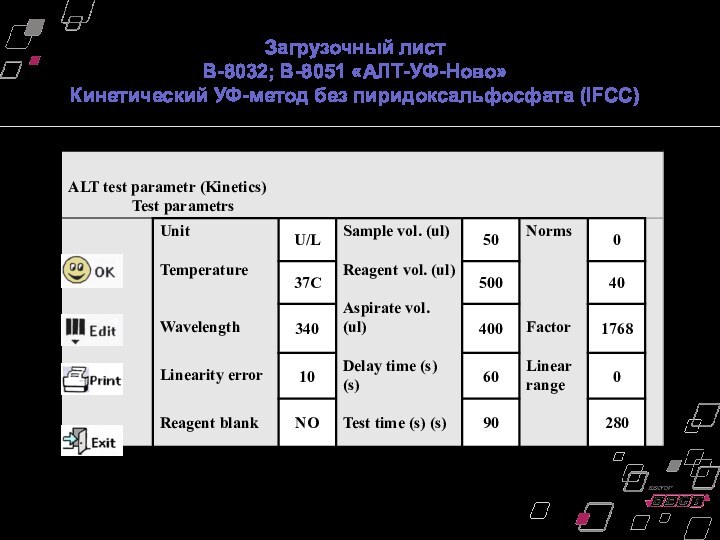
Загрузочный лист
В-8032; В-8051 «АЛТ-УФ-Ново»
Кинетический УФ-метод без пиридоксальфосфата
(IFCC)
Слайд 51
Регулярно проверяйте правильность и воспроизводимость результатов анализов по
контрольным сывороткам в соответствие с приказом № 220,
участвуйте в
ФСВОК и других системах
Внешней оценки качества.
Слайд 52
«Главная задача лаборатории – предоставление врачам-клиницистам надёжных качественных
и количественных результатов исследований проб пациентов. Поэтому все лаборатории
должны иметь систему контроля и поддержания качества их работы»