Слайд 2
Задачи биохимии растений
Биохимия изучает отдельные этапы обмена веществ,
их взаимосвязь и взаимообусловленность, физиологическую роль веществ, процесс биосинтеза
органического вещества из простейших веществ.
Биохимия растений изучает состав и превращение веществ в растениях и растительном сырье. Существуют также отраслевые биохимии: биохимия масличных растений и масличного сырья, биохимия молока, зерна, мяса, хлебных продуктов и т.д.
ООН предложила программу снабжения человечества пищей. Это может быть достигнуто прежде всего интенсивным путем. Поэтому основными задачами биохимии растений являются:
Повышение качества исходного сырья, изучение его химического состава и влияние его на технологию хранения и переработки.
Снижение потерь сырья в процессе хранения и технологической переработки.
Создание новых высокоэффективных технологий с целью повышения качества готовой продукции.
Комплексная безотходная технология переработки сырья и утилизация отходов.
Слайд 3
Биохимические особенности растений
1. Способность растений синтезировать органические соединения
из СО2 и Н2О и поступающих из почвы неорганических
веществ (NO3−, SO42−, PO43−). Эти неорганические соединения поставляют растению шесть элементов: углерод, водород, кислород, азот, серу и фосфор, из которых построено подавляющее большинство компонентов тканей: белки, углеводы, липиды, нуклеиновые кислоты и т.д.
2. Колоссальное разнообразие синтезируемых в растениях органических соединений. Растения могут образовывать соединения, присущие только им: терпеноиды, алкалоиды, фенольные соединения и другие.
3. Зеленое растение способно улавливать энергию солнечного света и использовать ее для образования сложных органических соединений.
Слайд 4
История развития биохимиирастений
Константин Сигизмундович Кирхгоф (1764-1833) Юстус фон Либих (1803-1873)
Андрей Сергеевич
Фаминцын (1838-1918) Луи Пастер (1822-1895)
Дмитрий Иосифович Ивановский (1864-1920) Эдуард Бухнер (1860-1917)
Иван Парфеньевич
Бородин (1847-1930) Отто Варбург (1883-1970)
Алексей Николаевич Бах (1857-1946) Ханс Кребс (1900-1981)
Владимир Иванович Палладин (1859-1922) Мелвин Эллис Кальвин (1911-1997)
Сергей Павлович Костычев (1877-1931)
Климент Аркадьевич Тимирязев (1843-1920)
Дмитрий Николаевич Прянишников (1865-1948)
Андрей Львович Курсанов (1902-1999)
Александр Иванович Опарин (1894-1980)
Вацлав Леонович Кретович (1907-1993)
Николай Иванович Лунин (1854-1937)
Михаил Семенович Цвет (1872—1919)
Слайд 6
Метаболизм
Катаболические пути – это процессы деградации, в ходе
которых крупные молекулы разрушаются (обычно в окислительных реакциях) с
выделением свободной химической энергии. Эта энергия используется организмом для поддержания жизнедеятельности, для роста и развития, а также преобразуется в другие формы энергии – механическую, химическую, тепловую
Анаболические пути – это процессы синтеза. В ходе этих процессов из относительно простых предшественников строятся сложные органические компоненты клетки. Синтез часто включает восстановительные этапы и сопровождается затратой свободной химической энергией
Слайд 9
Оксидоредуктазы
Катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления.
Класс

насчитывает 22 подкласса. Подклассы делят на подподклассы.
Коферментами этого класса
являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота.
подклассы - группы ферментов, действующие на:
1.1. CH-OH группу доноров;
1.2. альдегидную или кетоновую группу доноров;
1.3. CH-СH группу доноров;
1.4. CH-NH2 группу доноров;
1.5. CH-NН группу доноров;
1.6. НАДH или НАДФН в качестве доноров;
1.8. содержащие серу группы доноров;
1.9. гем-содержащие доноры;
1.10. дифенолы в качестве доноров;
1.11. пероксид водорода в качестве акцептора;
1.11. водород в качестве донора;
1.13. один донор с включением молекулярного кислорода;
1.14. два донора с включением молекулярного кислорода;
1.15. супероксидные радикалы в качестве акцептора;
1.17. СН2 группу доноров;
1.18. ферредоксин в качестве донора;
1.19. флаводоксин в качестве донора;
1.20. фосфор или мышьяк в качестве донора;
1.21. на вещества Х-Н и Y-Н с образованием X-Y-связи;
1.22. галоген в качестве донора;
1.97. другие оксидоредуктазы.
Слайд 10
Оксидоредуктазы
Наиболее распространены следующие рабочие названия оксидоредуктаз:
1. Дегидрогеназы –
оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора
водорода любых молекул, кроме кислорода.
2. Если перенос водорода от молекулы донора трудно доказуем, то такие оксидоредуктазы называют редуктазами.
3. Оксидазы – оксидоредуктазы, катализирующие окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата.
4. Монооксигеназы – оксидоредуктазы, катализирующие внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
5. Диоксигеназы – оксидоредуктазы, катализирующие внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
6. Пероксидазы – оксидоредуктазы, катализирующие реакции с пероксидом водорода в качестве акцептора электронов.
Слайд 11
Оксидоредуктазы
Систематическое название образуется:
Донор электронов : акцептор электронов –
оксидоредуктаза.
Сукцинатдегидрогеназа
Систематическое название – Сукцинат : ФАД-оксидоредуктаза
Рабочее название – Сукцинатдегидрогеназа
Класс
1. Оксидоредуктазы
Подкласс 1.3. Действующие на СН-СН-группу доноров
Подподкласс 1.3.99. с ФАД+ в качестве акцептора
Классификационный номер КФ 1.3.99.1.
Кофакторы – Флавинадениндинуклеотид
Слайд 12
Трансферазы
Катализируют реакции переноса различных групп от одного субстрата (донор)

к другому (акцептор), участвуют в реакциях взаимопревращения различных веществ,
обезвреживания природных и чужеродных соединений.
Коферментами являются пиридоксальфосфат, коэнзим А, тетрагидрофолиевая кислота, метилкобаламин. Класс подразделяется на 9 подклассов в зависимости от строения переносимых групп.
Примером подклассов являются ферменты, переносящие одноуглеродные фрагменты, альдегидные или кетоостатки, ацильные остатки, азотсодержащие группы, фосфорсодержащие группы.
Подклассы - группы ферментов,
2.1. переносящие одноуглеродные фрагменты;
2.2. переносящие альдегидные и кетогруппы;
2.3. переносящие ацильные группы;
2.4. переносящие гликозильные группы;
2.5. переносящие неметильные алкильные и арильные группы;
2.6. переносящие азотсодержащие группы;
2.7. переносящие фосфорсодержащие группы.
2.8. переносящие сульфосодержащие группы;
2.9. переносящие селенсодержащие группы.
На подподклассы деление производится также в зависимости от вида переносимой группы – метил (2.1.1.), карбоксиметил или формил (2.1.2.), амино-группы (2.6.1.).
Слайд 13
Трансферазы
Часто встречается рабочее название трансфераз – киназы. Это
трансферазы, катализирующие перенос фосфата от АТФ на субстрат (моносахариды,
белки и др), т.е. фосфотрансферазы.
Систематическое название образуется:
Донор группы : акцептор группы – переносимая группа трансфераза.
Гексокиназа
Систематическое название – АТФ:D-гексоза-6-фосфотрансфераза
Рабочее название – Гексокиназа
Класс 2. Трансферазы
Подкласс 2.7. Переносящие фосфорсодержащие группы
Подподкласс 2.7.1. Со спиртовой группой в качестве акцептора
Классификационный номер КФ 2.7.1.1.
Кофакторы Магний.
Слайд 14
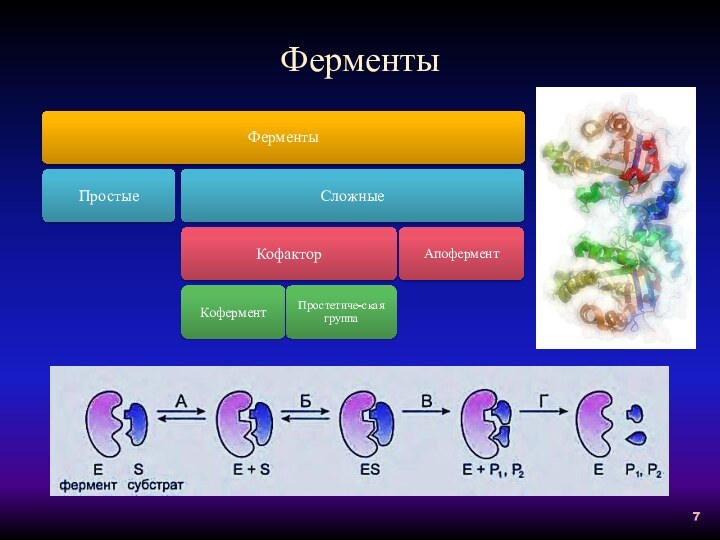
Гидролазы
Ферменты, осуществляющие разрыв внутримолекулярных связей в субстрате (за
исключением С-С связей) путем присоединения элементов Н2О.
Подразделяются на 13
подклассов.
Коферменты отсутствуют.
Примером подклассов служат группы ферментов, действующие на сложные эфиры, на простые эфиры, на пептиды, на углерод-углеродные связи.
Подклассы - группы ферментов, катализирующие гидролиз:
3.1. сложных эфиров;
3.2. О-гликозидов;
3.3. простых эфиров;
3.4. пептидов;
3.5. не пептидных азот-углеродных связей;
3.6. ангидридов кислот;
3.7. углерод-углеродных связей;
3.8. связей с участием галогена;
3.9. связей фосфор-азот;
3.10. связей сера-азот;
3.11. связей углерод-фосфор;
3.12. связей сера-сера;
3.13. связей углерод-сера.
Среди подподклассов выделяют гидролазы карбоновых кислот (3.1.1.), гидролазы фосфомоноэфиров (3.1.3.).
Слайд 15
Гидролазы
Ввиду сложности многих субстратов у ряда ферментов сохранены
тривиальные названия, например, пепсин.
Исторически названия гидролаз складывались из
названия субстрата с окончанием «-аза» – коллагеназа, амилаза, липаза, ДНК-аза. Наиболее часто встречаются следующие рабочие названия гидролаз:
1. Эстеразы – гидролиз сложноэфирных связей.
2. Липазы – гидролиз нейтральных жиров (триацилглицеролов).
3. Фосфатазы – гидролиз моноэфиров фосфорной кислоты.
4. Гликозидазы – гидролизуют О- и S-гликозидные связи.
5. Протеазы, пептидазы – гидролиз белков и пептидов.
6. Нуклеазы – гидролиз нуклеиновых кислот.
Слайд 16
Гидролазы
Часто встречается рабочее название трансфераз – киназы. Это
трансферазы, катализирующие перенос фосфата от АТФ на субстрат (моносахариды,
белки и др), т.е. фосфотрансферазы.
Систематическое название образуется:
Гидролизуемый субстрат : отделяемая группа гидролаза.
Глутаминаза
Систематическое название – L-глутамин:амидгидролаза
Рабочее название – Глутаминаза
Класс 3. Гидролазы
Подкласс 3.5. Действующие на связи углерод-азот (не пептидные)
Подподкласс 3.5.1. Действующие в линейных амидах
Классификационный номер КФ 3.5.1.2
Слайд 17
Лиазы
Ферменты, катализирующие разрыв С-О, С-С, C-N и других
связей, а также обратимые реакции отщепления различных групп негидролитическим
путем.
Выделяют 7 подклассов. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи.
Коферментами служат пиридоксальфосфат, тиаминдифосфат, участвует магний, кобальт.
Ферменты делятся на подклассы в зависимости от природы атакуемой связи.
Подклассы - группы ферментов, действующие на углерод-углеродные связи, углерод-кислородные связи, углерод-азотные связи:
4.1. углерод-углерод лиазы;
4.2. углерод-кислород лиазы;
4.3. углерод-азот лиазы;
4.4. углерод-сера лиазы;
4.5. фосфор-кислород лиазы.
Среди подподклассов выделяют, например, карбокси-лиазы (4.1.1.), гидро-лиазы 4.2.1.).
Слайд 18
Лиазы
Систематическое название образуется:
Расщепляемый субстрат : отделяемая группа –
лиаза.
Аденилатциклаза
Систематическое название – АТФ:дифосфат-лиаза (циклизующая)
Рабочее название – Аденилатциклаза
Класс 4. Лиазы
Подкласс 4.6.
Фосфор-кислород-лиазы
Подподкласс 4.6.1. Фосфор-кислород-лиазы
Классификационный номер КФ 4.6.1.1.
Слайд 19
Изомеразы
Ферменты, катализирующие изомерные превращения в пределах одной молекулы.
Коферменты: пиридоксальфосфат, дезоксиаденозилкобаламин, глутатион, фосфаты моносахаридов (глюкозо-1,6-дифосфат) и др.
Подклассы
- группы ферментовпо типу изомеризации:
5.1. рацемазы и эпимеразы. Рацемазы отвечают за взаимопревращения L- и D-изомеров, S- и R-изомеров. Эпимеразы изменяют конфигурацию при одном из хиральных атомов углерода, например: взаимопревращение α- и β-изомеров, превращения рибулоза↔ксилулоза, галактоза↔глюкоза, манноза↔галактоза;
5.2. цис-транс изомеразы;
5.3. внутримолекулярные оксидоредуктазы;
5.4. внутримолекулярные трансферазы – мутазы;
5.5. внутримолекулярные лиазы.
Среди подподклассов выделяют, например: действующие на аминокислоты и их производные (5.1.1.), на углеводы и их производные (5.1.3.), перемещающие двойные (С=С) связи (5.3.3.).
Слайд 20
Изомеразы
Систематическое название образуется:
Субстрат – [ ] – реакция,
где [ ] – обозначение, отражающее суть реакции, например,
"номер изменяемого атома углерода", изменение "цис-транс", изменение "кето-енол", изменение "альдозо-кетозо".
Триозофосфат-изомераза
Систематическое название – D глицеральдегид-3-фосфат-альдозо-кетозо-изомераза
Рабочее название – Триозофосфат-изомераза
Класс 5. Изомеразы
Подкласс 5.3. Внутримолекулярные оксидоредуктазы
Подподкласс 5.3.1. Катализирующие взаимопревращения альдоз и кетоз
Классификационный номер КФ 5.3.1.1.
Слайд 21
Лигазы (синтетазы)
Ферменты, катализирующие присоединение друг к другу двух
молекул с использованием энергии высокоэнергетических связей АТФ (или других
макроэргов).
Коферменты: нуклеотидные (УТФ), биотиновые (витамин Н), фолиевые.
Выделяют 6 подклассов.
Подклассы - группы ферментов, формирующих связи:
6.1. углерод-кислород;
6.2. углерод-сера;
6.3. углерод-азот;
6.4. углерод-углерод;
6.5. фосфор-кислород;
6.6. азот-металл.
Среди подподклассов выделяют ферменты, синтезирующие соединения типа кислота-тиол (6.2.1.), амиды (6.3.1.).
Слайд 22
Лигазы (синтетазы)
Систематическое название образуется:
Субстрат 1 : субстрат 2
– лигаза.
Глутаминсинтетаза
Систематическое название – L-глутамат:аммиак-лигаза
Рабочее название – Глутаминсинтетаза
Класс 6. Лигазы
Подкласс 6.3.
Образующие связи углерод-азот
Подподкласс 6.3.1. Амид-синтетазы
Классификационный номер КФ 6.3.1.2.
Слайд 23
Факторы, влияющие на скорость ферментативных реакций
Слайд 24
Факторы, влияющие на скорость ферментативных реакций
Слайд 25
Факторы, влияющие на скорость ферментативных реакций
Слайд 26
Факторы, влияющие на скорость ферментативных реакций
Слайд 27
Факторы, влияющие на скорость ферментативных реакций
Слайд 28
Факторы, влияющие на скорость ферментативных реакций
Слайд 29
Факторы, влияющие на скорость ферментативных реакций
Слайд 30
Факторы, влияющие на скорость ферментативных реакций
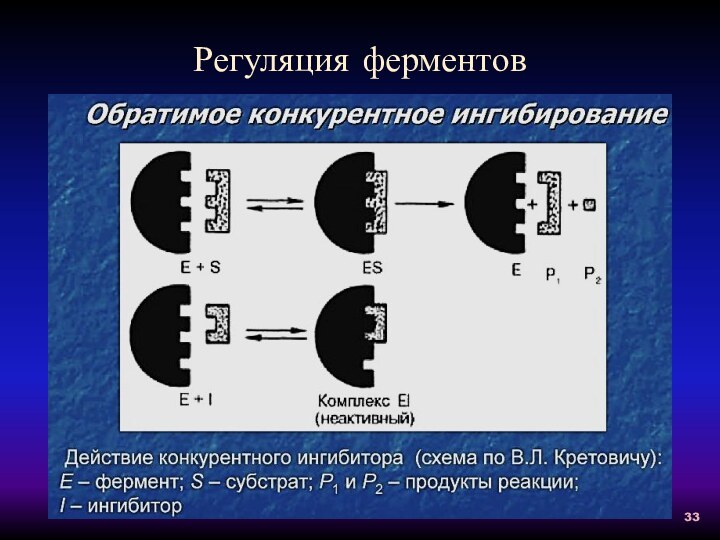
Конкурентное ингибирование: 1 -
без ингибитора;
2 - с конкурентным ингибитором
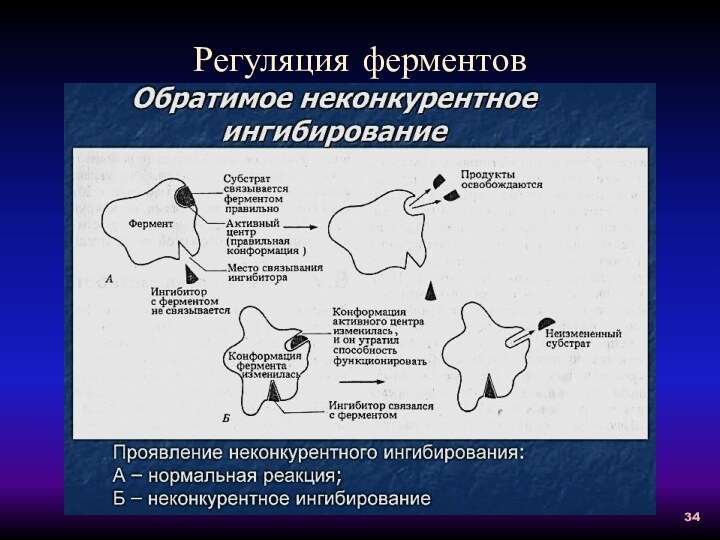
Неконкурентное ингибирование:
1- без ингибитора;
2 - с неконкурентным ингибитором
Слайд 31
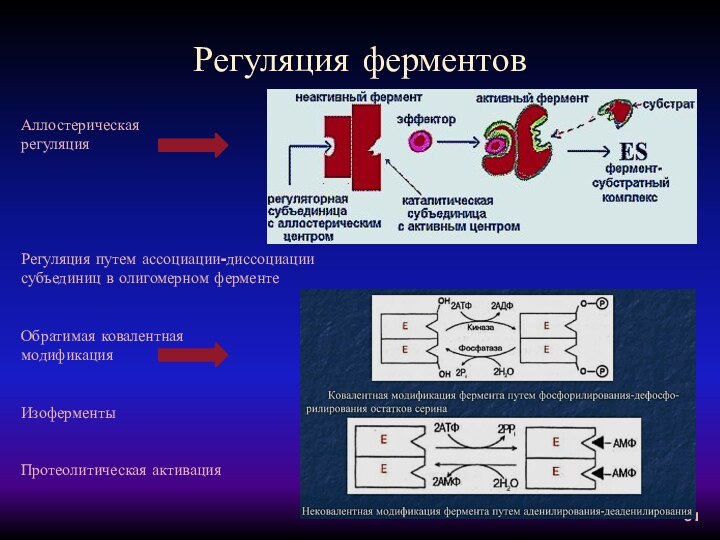
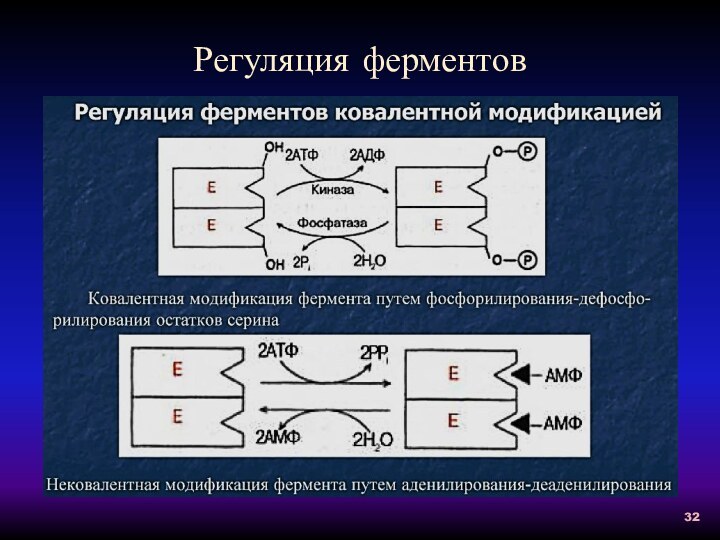
Регуляция ферментов
Аллостерическая
регуляция
Регуляция путем ассоциации-диссоциации
субъединиц в олигомерном
ферменте
Обратимая ковалентная
модификация
Изоферменты
Протеолитическая активация
Слайд 37
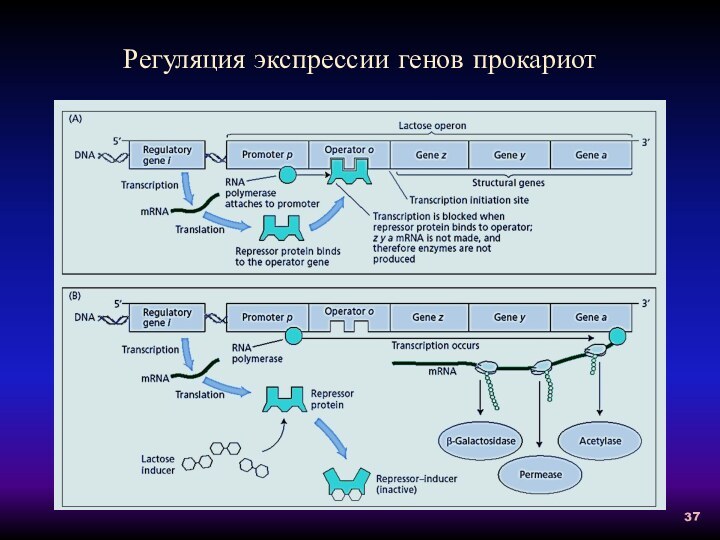
Регуляция экспрессии генов прокариот
Слайд 38
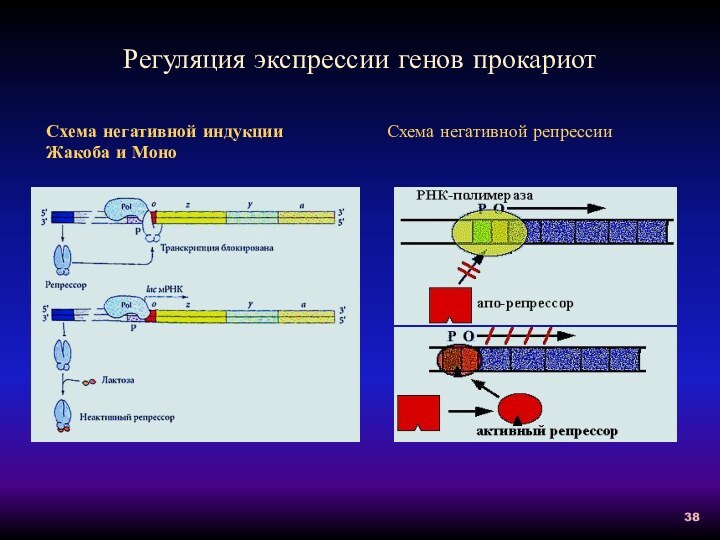
Регуляция экспрессии генов прокариот
Схема негативной индукции Жакоба и
Моно
Схема негативной репрессии
Слайд 39
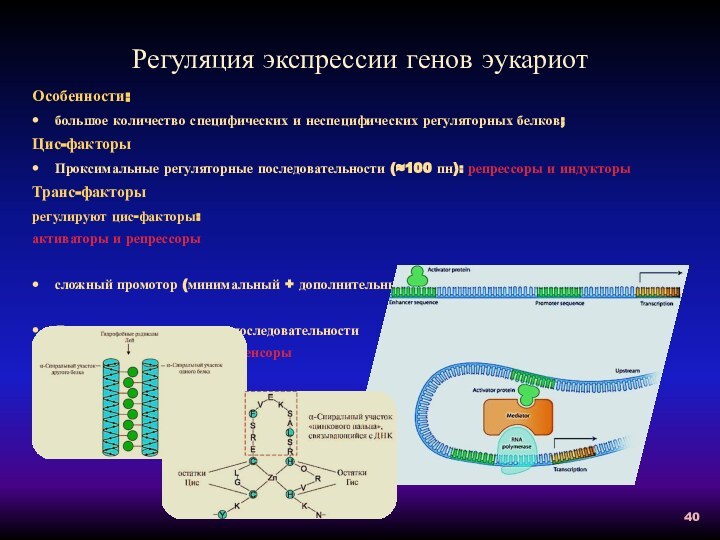
Регуляция экспрессии генов прокариот
Схема позитивной индукции
Схема позитивной репрессии


















![Физиология обмена веществ у растений ИзомеразыСистематическое название образуется:Субстрат – [ ] – реакция, где [ ] –](/img/tmb/13/1250489/7040bcc96765584946af5252d83ff805-720x.jpg)