- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Фосфор
Содержание
- 2. СодержаниеОбщая характеристика элементаФизические свойства Распространенность Получение Химические свойства фосфора ПрименениеБиологическая роль
- 3. Фосфор (лат. Phosphorus) – химический элемент V
- 4. Физические свойства Элементарный фосфор
- 5. Распространенность Среднее содержание фосфора
- 6. Получение Фосфор открыт гамбургским
- 7. Химические свойства фосфора Химическая
- 8. Соединения фосфора со
- 9. Н3РО4 – кислота
- 10. ПрименениеЭлементарный фосфорНаиболее активен химически, токсичен и горюч
- 11. Фосфор присутствует в
- 12. Скачать презентацию
- 13. Похожие презентации











Слайд 2
Содержание
Общая характеристика элемента
Физические свойства
Распространенность
Получение
Химические свойства
фосфора
Слайд 3 Фосфор (лат. Phosphorus) – химический элемент V группы
главной подгруппы 3 периода периодической системы элементов. Неметалл
Символ
Р Атомная номер 15
Атомная масса 30,973 а.е.м.
Валентный уровень 3s23р3
Радиус атома 128 пм
Электроотрицательность 2,19
Природный фосфор состоит из одного стабильного изотопа 31Р.
Получено шесть искусственных радиоактивных изотопов:
28P (T1/2 = 6,27 сек), 29P (T1/2 = 4,45 сек); 30P (T1/2 = 2,55 мин),
31P (T1/2 = 14,22 сут), 32P (T1/2 = 25 сут), 33P (T1/2 = 12,5 сек).
Наибольшее значение имеет 32P, обладающий значительной энергией b-излучения и применяемый в химических и биохимических исследованиях в качестве меченого атома.
Изотопы
Слайд 4
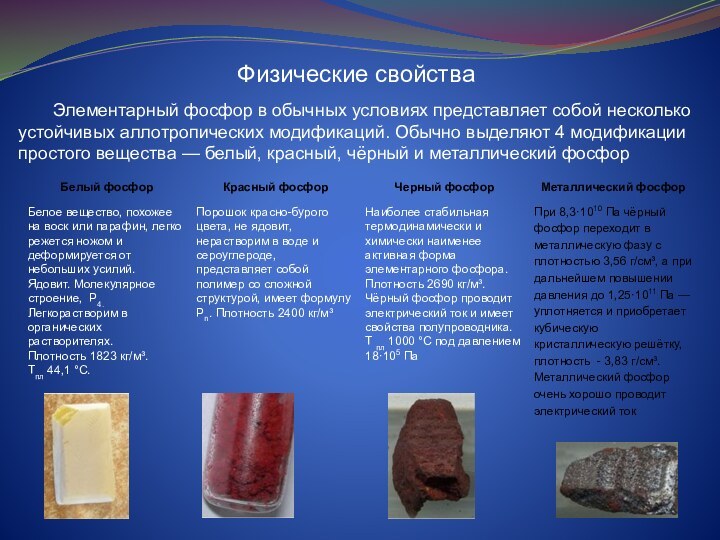
Физические свойства
Элементарный фосфор в
обычных условиях представляет собой несколько устойчивых аллотропических модификаций. Обычно
выделяют 4 модификации простого вещества — белый, красный, чёрный и металлический фосфор
Слайд 5
Распространенность
Среднее содержание фосфора в
земной коре 0,105% по массе, в воде морей и
океанов 0,07 мг/л.Известно около 200 фосфорных минералов, они представляют собой фосфаты. Из них важнейший - апатит, который является основой фосфоритов.
Практическое значение имеют также:
монацит CePO4 ксенотим YPO4
амблигонит LiAlPO4(F, ОН) трифилин Li(Fe, Mn)PO4
торбернит Cu(UO2)2(PO4)2· 12H2O отунит Ca(UO2)2(PO4)2 · 10H2O
вивианит Fe3(PO4)2· 8H2O пироморфит Рb5(РО4)3Сl
бирюза СuАl6(РО4)4(ОН)8· 5Н2О
Апатит
Монацит
Бирюза
Торбернит
Слайд 6
Получение
Фосфор открыт гамбургским алхимиком
Хеннигом Брандом в 1669 г. Подобно другим алхимикам, Бранд
пытался отыскать философский камень, а получил светящееся вещество. Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем. Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 г. Усовершенствованный способ получения фосфора был опубликован в 1743 г. Андреасом Маргграфом.Хенниг Бранд
В настоящее время фосфор получают накаливанием в электропечах при 1500 ⁰С смеси фосфорита или апатита (основной компонент Са3(РО4)2 ) с песком и углем. При высокой темратуре образуются молекулы фосфора:
2 Са3(РО4)2 + 10 C + 6 SiO2 = 10 CO↑ + 6 CaSiO3 + P4↑
Слайд 7
Химические свойства фосфора
Химическая активность
фосфора значительно выше, чем N2
Фосфор как восстановитель:
5 O2
+ 4 P = 2 P2O5 3 O2 + 4 P = 2 P2O3 (недостаток O2)3 Cl2 + 2 P = 2 PCl5 3 I2 + 2 P = 2 PI3
3 P + 5 HNO3 + 2 H2O = 3 H3PO4 + 5 NO
2 P + 5 CuSO4 + 8 H2O = 5 H2SO4 + 5 Cu + 2 H3PO4
Фосфор как окислитель: 2 P + 3 Mg = Mg3P2 (фосфид магния)
Фосфин, PH3 – ядовитый газ, бесцветен, плохо растворим в Н2О, нестоек:
Ca3P2 + 6 H2O = 3 Ca(OH)2 + 2 PH3↑
РН3 – более слабое основание, чем NH3: PH3 + HI = [PH4]I – в воде соли фосфония полностью гидролизуются.
РН3 – сильный восстановитель: PH3 + 2 O2 = H3PO4
Соединения фосфора с металлами имеют название фосфиды :
3 Ca + 2 P = Ca3P2
Элементарный фосфор
Соединения фосфора в ст.ок. -3
Слайд 8 Соединения фосфора со ст.ок
+3образуются при недостатке окислителя:
2 P + 3 Cl2 →
2 PCl3 4 P + 3 O2 = 2 P2O3Оксид фосфора (III), P2O3 – кислотный оксид:
4 NaOH + P2O3 = 2 NaHPO3 + H2O
При взаимодействии с водой образуется двухосновная фосфористая кислота средней силы: P2O3 + 3 H2O = 2 H3PO3
Соли фосфористой кислоты – фосфиты , например NaHPO3.
P2O3 за счет Р в промежуточной ст.ок. может выступать в роли восстановителя: P2O3 + O2 = P2O5
Оксид фосфора (V), Р2О5 – белый порошок, получают сгоранием Р в избытке О2: 4 Р + 5 О2 = 2 Р2О5
P2O5 – кислотный оксид :
3 ВаО + Р2О5 = Ва3(РО4)2 6 NaOH + P2O5 = 2 Na3PO4 + 3 H2O
P2O5 – cильное водоотнимающее средство: 6 HNO3 + P2O5 = 2 H3PO4 + 3 N2O5
При растворении в Н2О Р2О5 образует фософорные кислоты:
Р2О5 + Н2О → (НРО3)n метафосфорная кислота n≥4
H4P4O12 + 2 H2O = 2 H4P2O7 пирофосфорная кислот
H4P2O7 + 2 H2O = 2 H3PO4 ортофосфорная или просто фосфорная кислота.
Соединения фосфора в ст.ок. +3
Соединения фосфора в ст.ок. +5
Слайд 9 Н3РО4 – кислота средней
силы, окислительной силы за счет Р(+5) не имеет. Образует
3 ряда солей: средние фосфаты (К3РО4, Са3(РО4)2 и др.); гидрофосфаты (СаНРО4, К2НРО4) и дигидрофосфаты (Са(НРО4)2, КН2РО4). Средние фосфаты, кроме фосфатов щелочных металлов, в воде нерастворимы.Фосфаты подвергаются гидролизу: PO43- + H2O = OH- + HPO42-
Качественная реакция: 3Ag++PO43-=Ag3PO4 ярко-желты осадок (при рН=7)
Получение в промышленности: Ca3(PO4)2 + 3 H2SO4 = 2 H3PO4 + 3CaSO4↓
Фосфата, использующиеся в качестве удобрений:
Са3(РО4)2 - молоты фосфорит, фосфоритная мука – нерастворим в воде.
Ca3(PO4)2 + 2 H2SO4 = Ca(H2PO4)2 + 2 CaSO4 – суперфосфат
Ca3(PO4)2 + 4 H3PO4 = 3 Ca(H2PO4)2 – двойной суперфосфат
Ca(OH)2 + 2 H3PO4 = CaHPO4 + 2H2O – преципитат, нерастворим в Н2О, растворим только в кислых почвах
3 NH3 + 2 H3PO4 = NH4H2PO4 + (NH4)2HPO4 – аммофос + соль калия – аммофоска
Ортофосфорная кислота, Н3РО4
Соли ортофосфорной кислоты - фосфаты
Слайд 10
Применение
Элементарный фосфор
Наиболее активен химически, токсичен и горюч белый
фосфор, потому он очень часто применяется в зажигательный бомбах.
Красный фосфор – основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) используется в виде фосфорных удобрений.
Соединения фосфора в промышленности
Фосфаты широко используются в качестве:
- комплексообразователей (средства для умягчения воды),
- в составе пассиваторов поверхности металлов (защита от коррозии)
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.
Слайд 11 Фосфор присутствует в живых
клетках в виде орто- и пирофосфорной кислот, входит в
состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит.Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800—1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
Фосфор поступает в организмы человека и животных с продуктами питания и кормом в виде фосфолипидов, фосфопротеидов, нуклеотидов.
Для восполнения дефицита фосфора в кормах с/х животных применяют кормовые фосфаты, которые способствуют нормализации обмена веществ.
.
Биологическая роль





























