Слайд 2
Геохимические характеристики кислорода
Самый распространенный элемент земной коры (47%),
гидросферы (85,7%) и живого вещества (70%). Большая действующая масса
кислорода сочетается с его высокой химической активностью. В земной коре преобладают кислородные минералы (1394).
Сильный окислитель. Определяет окислительно-восстановительные и щелочно-кислотные условия растворов и расплавов.
Слайд 3
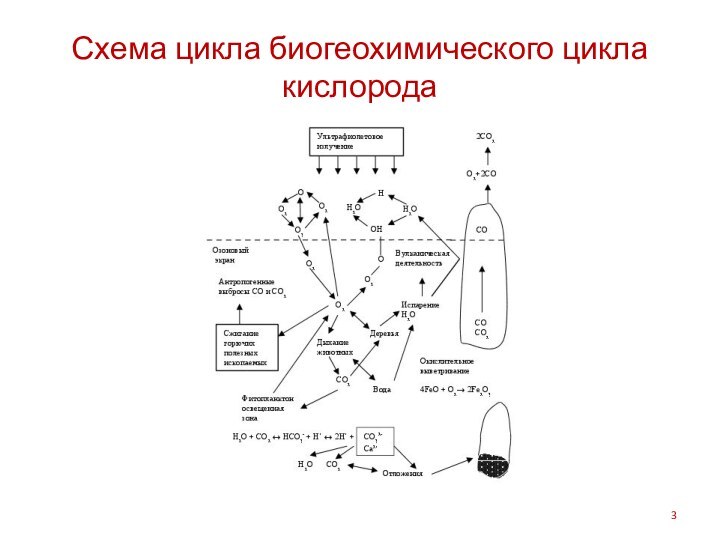
Схема цикла биогеохимического цикла кислорода
Слайд 4
Составляющие биогеохимического цикла кислорода
Выделение в процессе фотосинтеза и

поглощение при окислении, дыхании.
Массообмен в системе Мировой океан –
атмосфера.
Исходным «сырьем» для образования кислорода посредством реакций фотолиза и фотосинтеза служит вода. Связывание 1 г углерода в органическое вещество при реакции фотосинтеза сопровождается выделением примерно 2,7 г кислорода в результате расщепления молекул воды.
В настоящее время в атмосфере содержится 1,185×1015 т кислорода.
Суммарное выделение кислорода фотосинтетиками суши и океана – (300-350) ×109 т/год.
Исходя из величин ежегодного выделения кислорода, его запас в атмосфере может быть удвоен примерно за 4000 лет. Но этого не происходит, т.к. на протяжении года разными путями разлагается такое количество органического вещества, которое почти равно образованному при фотосинтезе, и при этом поглощается почти весь выделившийся кислород. Тем не менее благодаря сохранению части органического вещества свободный кислород постепенно накапливался в атмосфере.
Слайд 5
Массобмен в системе тропосфера – природные воды
Второй миграционный
цикл свободного кислорода связан с массобменом в системе тропосфера
– природные воды. В 1 л воды растворено 2-8 см3 О2. Следовательно, в воде океана находится (3-10) ×109 м3 растворенного О2. Холодная вода высоких широт поглощает кислород; поступая с океаническими течениями в тропический пояс, она выделяет О2. В годовой массообмен между атмосферой и океаном вовлекается около 0,5% атмосферного кислорода, т.е. 5900×109 т. Это почти в 20 раз больше биогенного продуцирования кислорода.
Слайд 6
Геохимические характеристики водорода
Главный элемент космоса, но в планетах
земной группы его немного: кларк гранитоидов 0,15%, гидросферы 10,72;
живого вещества 10,5%.
В земной коре большая часть водорода входит в состав воды, углей, нефти, горючих газов, живых организмов, глинистых минералов.
Свободный водород в земной коре неустойчив, он быстро соединяется с кислородом, образуя воду.
В земной коре известен и глубинный водород, поступающий по зонам разломов. Предполагается его присутствие в мантии и ядре («гипотеза гидридного ядра»).
Очень велика в земной коре роль воды, водородного (Н+) и гидроксильного (ОН-) ионов.
Слайд 7
Диссипация водорода
Водород и гелий благодаря ничтожной массе их
ядер могут диссипировать: уходить из поля тяготения Земли. Гелий,
как инертный газ, не образует химических соединений, а водород под влиянием жизнедеятельности организмов вступает в соединения и вследствие этого задерживается в биосфере.
Водород в свободной (молекулярной) форме и в составе химических соединений активно дегазируется из мантии. Значительные массы Н2 поступают на поверхность Земли при вулканических извержениях и поствулканических процессах, выделяются в результате жизнедеятельности водородных бактерий, участвующих в преобразовании органического вещества в анаэробных условиях, образуются при разложении воды при электрохимических реакциях и под воздействием продуктов распада радиоактивных элементов. В то же время в атмосфере находится всего 0,18×109 т Н2 благодаря его диссипации. Скорость диссипации водорода 25×103 т/год. За время существования Земли общая потеря элемента составила 0,1×1015 т.
Слайд 8
Накопление кислорода и удаление водорода из атмосферы
Накопление кислорода
в атмосфере тесно связно с удалением из неё водорода.
На ранних стадиях истории Земли ведущую роль в удалении водорода, образовывавшегося при фотолизе паров воды, играл процесс диссипации. В дальнейшем все большее значение стало приобретать удаление водорода путем связывания его в составе органического вещества. Для создания массы растительности Мировой суши, существовавшей до вмешательства человека, было расщеплено примерно 1,8×1012 т воды и соответственно связано 0,3×1012 т Н2. В настоящее время в процессе фотосинтеза природной растительностью на суше и фотосинтетиками в океане на протяжении года расщепляется около 200×109 т воды и в органическом веществе связывается примерно (30-35) ×109 т водорода.
Слайд 9
Фракционирование изотопов кислорода и водорода
Водород представлен изотопами:
1Н (протий)

– распространенность 99,984%,
2Н (D – дейтерий) – около
0,0156%,
3Н (Т - тритий) – радиоактивный.
Кислород состоит из трех стабильных изотопов:
16О (99,759%),
17О (0,0374%),
18О (0,203%).
В процессе круговорота воды в биосфере происходит однонаправленное фракционирование изотопов кислорода и водорода: возрастание дейтерия сопровождается возрастанием тяжелого изотопа кислорода 18О. Пары воды при испарении обогащаются легкими изотопами, поэтому атмосферные осадки, поверхностные и грунтовые воды содержат больше легких изотопов. Материковые льды Арктики и Антарктиды содержат наиболее легкую воду, т.к. активность разделения изотопов кислорода усиливается при понижении температуры. Воды океана обладают постоянным изотопным составом. Больше всего тяжелой воды в соленых озерах.
Тяжелая вода D2O и HD16O. Отличается от обычной: замерзает при 3,8°С, кипит при 101,4°С; в ней меньше скорость реакций и растворимость солей. Ядовита для организмов.