Слайд 2
1901 год Ландштейнер впервые опубликовал наблюдения о существовании
различий среди эритроцитов человека, разделил людей на 3 группы:
А, В и С.
1907 год Янский, исследуя групповую принадлежность больных, установил наличие группы крови АВ.
Слайд 3
ПРАВИЛО ЛАНДШТЕЙНЕРА:
Здоровые индивиды имеют в сыворотке
антитела к антигенам, отсутствующим на их эритроцитах.
Слайд 4
Наличие антигенов на эритроцитах и антител в сыворотке
у различных групп крови
Слайд 5
СПОСОБЫ ОПРЕДЕЛЕНИЯ ГРУППЫ КРОВИ АВ0:
по антигенам, содержащихся в
исследуемых эритроцитах, в этом случае используют моноклональные антитела;
по антигенам
и антителам, содержащимся в исследуемой сыворотке крови, в этом случае используют моноклональные антитела и стандартные эритроциты групп крови А, В, 0.
Слайд 6
ПРАВИЛА, КОТОРЫЕ НАДО СОБЛЮДАТЬ ПРИ ИССЛЕДОВАНИИ ГРУППЫ
КРОВИ:
использовать для исследования реактивы, в качестве которых нет
сомнения;
исследование проводить перекрестным методом , не использовать для исследования эритроциты А и В от произвольно взятых лиц, применять только стандартные эритроциты;
использовать моноклональный реагент АВ для контроля специфичности реакции агглютинации;
кровь для исследования брать до проведения больному гемотрансфузий;
кровь для исследования брать до переливания плазмозамещающих растворов ( для исключения ошибок, вызванных склеиванием эритроцитов в монетные столбики);
обращать внимание на диагноз.
Слайд 7
ОПРЕДЕЛЕНИЕ ГРУПП КРОВИ СИСТЕМЫ АВ0 ПРИ ПОМОЩИ МОНОКЛОНАЛЬНЫХ
РЕАГЕНТОВ
ОСНАЩЕНИЕ:
моноклональные реагенты анти-А, анти-В и А+В (медиклоны, цоликлоны);
раствор натрия
хлорида 0,9%;
пластинки со смачиваемой поверхностью;
пипетки;
стеклянные или пластмассовые палочки.
Слайд 8
ПОРЯДОК ПРОВЕДЕНИЯ ИССЛЕДОВАНИЯ:
Промаркировать пластину для исследования;
Нанести по 1
большой капле (около 0,1 мл) каждого реагента на пластинку;
Нанести
по 1 маленькой капле ( около 0,03 мл) исследуемой крови (эритроцитов) рядом с каждым реагентом;
Смешать отдельными чистыми стеклянными палочками каждую каплю крови (эритроцитов) с соответствующим реагентом;
Покачивать пластинку, результат реакции учитывать через 3 мин после окончания смешивания.
Слайд 10
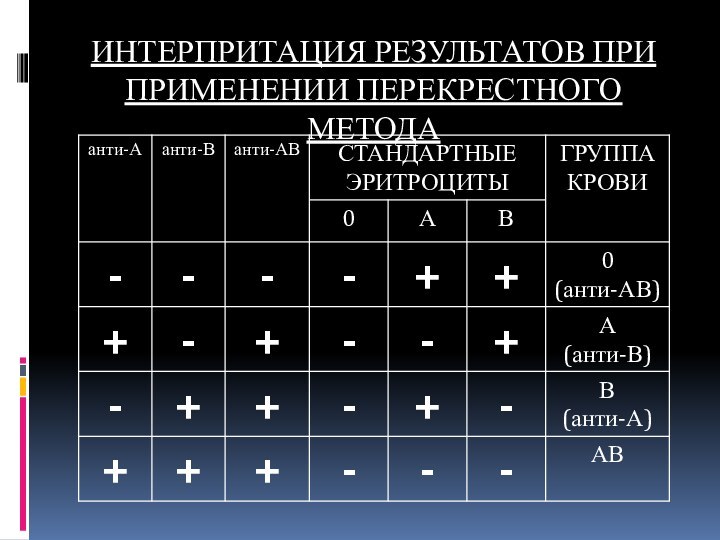
ИНТЕРПРИТАЦИЯ РЕЗУЛЬТАТОВ ПРИ ПРИМЕНЕНИИ ПЕРЕКРЕСТНОГО МЕТОДА
Слайд 14
ВАРИАНТЫ АНТИГЕНА А:
А1, (А2, А3…… Аn) n>30
А2
Есть правило, что все, что не относится к А1 обозначается А2 , в реальности истинным А2 может не являться;
Иммуногенность антигена А уменьшается в соответствии с индексом;
Важное клиническое значение – если А1нет, то в норме присутствуют антитела анти-А1;
Предотвращение несовместимости при переливании:
A А2 эритромасса 0
A А2B эритромасса В
Для определения используют реагент анти-А1.
Слайд 15
ОШИБКИ ПРИ ИССДЕДОВАНИИ ГРУППОВОЙ ПРИНАДЛЕЖНОСТИ
Неправильная маркировка пробирок с
кровью, взятой для исследования(перепутывание);
Ошибочный порядок нанесения цоликлонов на пластинку,
неправильная регистрация результатов исследования;
Нарушение техники исследования (неправильное соотношение моноклонального реагента и исследуемых эритроцитов, использование реагентов с истекшим сроком годности; сокращение времени наблюдения за реакцией; нарушение температурного режима окружающей среды).
Слайд 16
СИСТЕМА Rh
Система Rh состоит из 75 антигенов;
Наиболее иммуногенные
D, С, Е;
Наличие или отсутствие антигена на мембране эритроцитов
делит всех людей на “+” и “-”;
d – это условное обозначение отсутствия антигена D.
Слайд 17
РАЗНОВИДНОСТЬ АНТИГЕНА D
НОРМАЛЬНО ВЫРАЖЕННЫЙ D:
на эритроцитах присутствуют все
эпитопы (большинство индивидов);
D СЛАБЫЙ:
сниженное количество антигенных детерминант;
D ВАРИАНТНЫЙ:
количество антигенных
детерминант не снижено, но они отличаются;
Различия в подходах: донор реципиент
Слайд 18
ОПЕРЕДЕЛЕНИЕ РЕЗУС – ПРИНАДЛЕЖНОСТИ НА ПЛОСКОСТИ С МОНОНОКЛОНАЛЬНЫМИ
АНТИТЕЛАМИ АНТИ-D
ОСНАЩЕНИЕ:
моноклональные антитела анти-D (IgM);
смачиваемая пластинка;
раствор натрия хлорида 0,9%;
стеклянные
или пластмассовые палочки.
ПОРЯДОК ПРОВЕДЕНИЯ:
подписать на пластинке Ф.И.О. исследуемого лица;
соответственно надписям капнуть по 1 капле реактива анти-D и каплю контрольного реактива;
во все капли добавить по маленькой капле исследуемых эритроцитов и перемешать стеклянной палочкой(перемешивание начинать с контроля);
пластинку покачивать в течение 5 мин, затем в каждую каплю добавить 5-6 капель раствора натрия хлорида 0,9% для снятия возможной неспецифической реакции.
Результат трактуется как положительный при наличии агглютинации, как отрицательный при отсутствии агглютинации.