В
k1
k-1
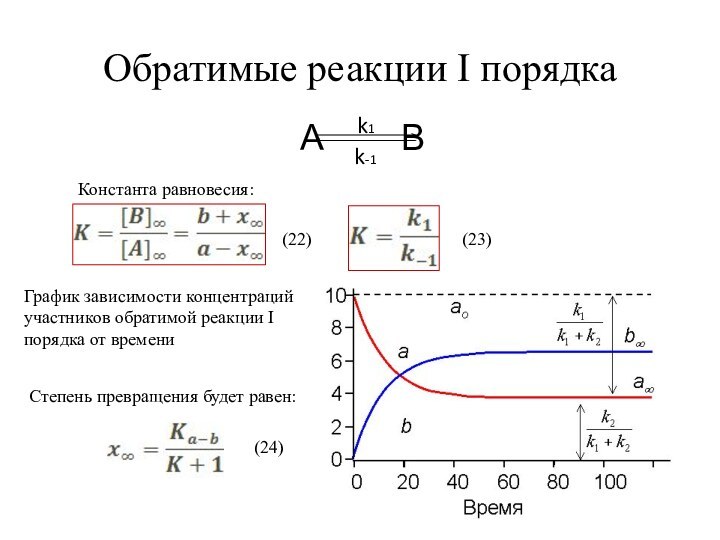
Особенность обратимых реакций - по мере накопления продуктов реакции возрастает скорость
обратной реакции. k 1 – константа скорости прямой реакции,
k –1 – константа скорости обратной реакции.
1.
2.
3.
Примеры обратимых реакций:



![Химическая кинетика.Кинетика обратимых реакций Обратимые реакции I порядкаПо закону действующих масс:x ([A] = a - x, [B] =b + x)Кинетические уравнения:А](/img/tmb/13/1272786/75d9f0961a359e8eeb90a85cb69afb9b-720x.jpg)


![Химическая кинетика.Кинетика обратимых реакций Обратимые реакции I порядкаА Вk1k-1(20)Значения концентраций [A]∞ и](/img/tmb/13/1272786/bdf3541619a49cabba941b3f91be4a6c-720x.jpg)