- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химия органических соединений
Содержание
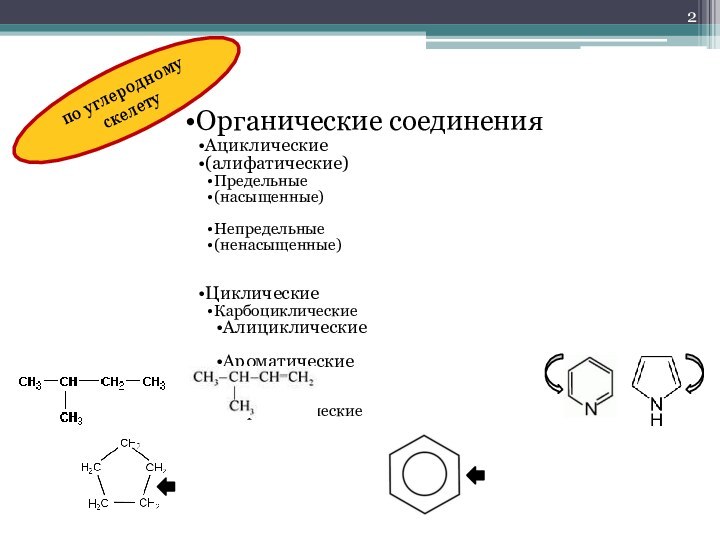
- 2. по углеродному скелету
- 3. по функциональным группам= O
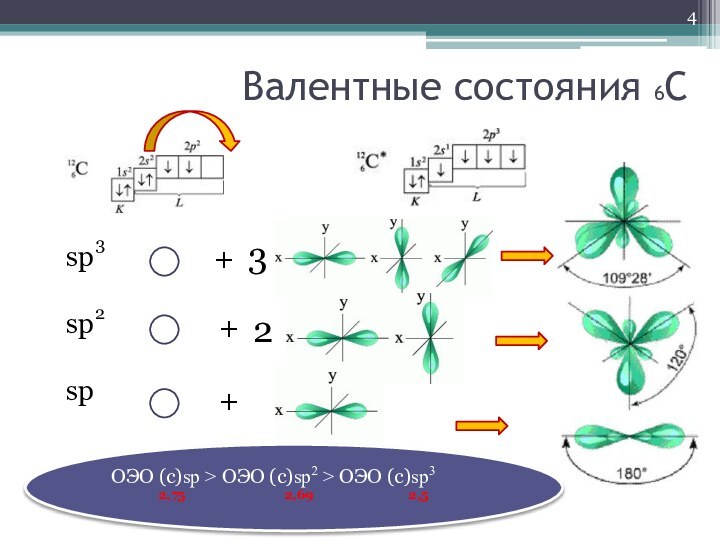
- 4. Валентные состояния 6Сspspsp23+++32ОЭО (с)sp > ОЭО (с)sp2
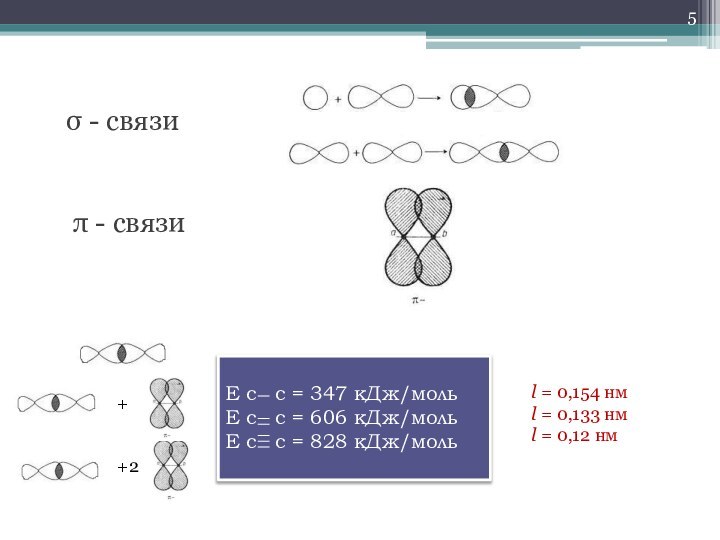
- 5. σ - связиπ - связиЕ с
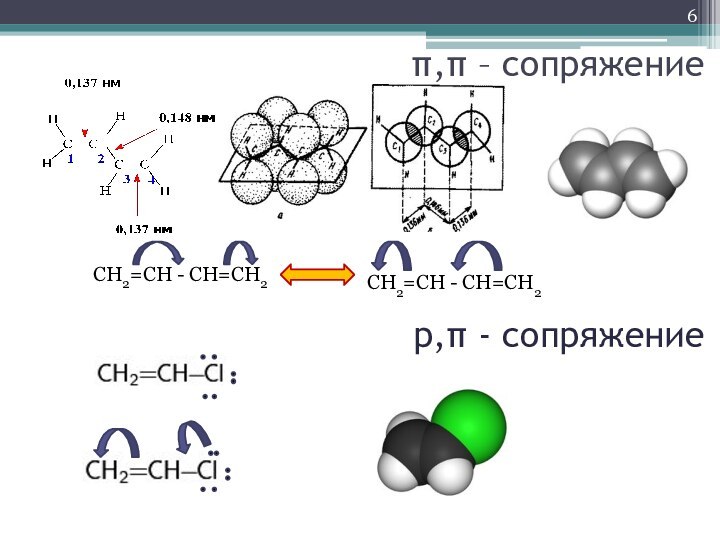
- 6. π,π – сопряжение СН2=СН - СН=СН2 СН2=СН - СН=СН2 р,π - сопряжение
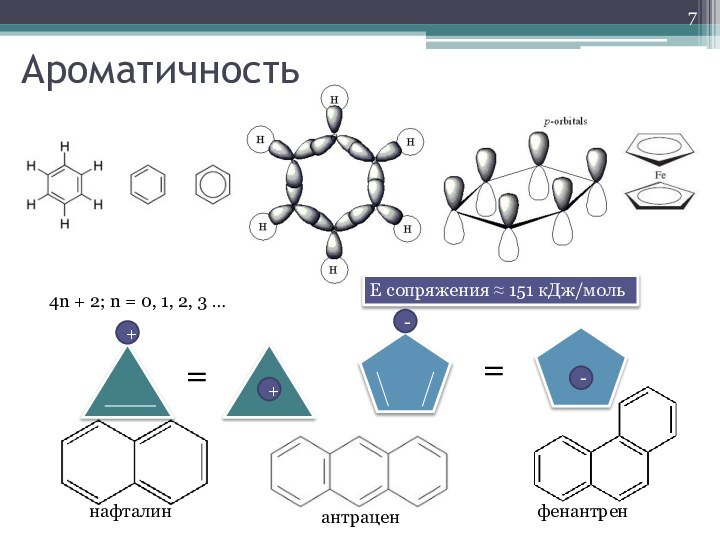
- 7. АроматичностьЕ сопряжения ≈ 151 кДж/моль4n + 2; n = 0, 1, 2, 3 …==++--нафталинантраценфенантрен
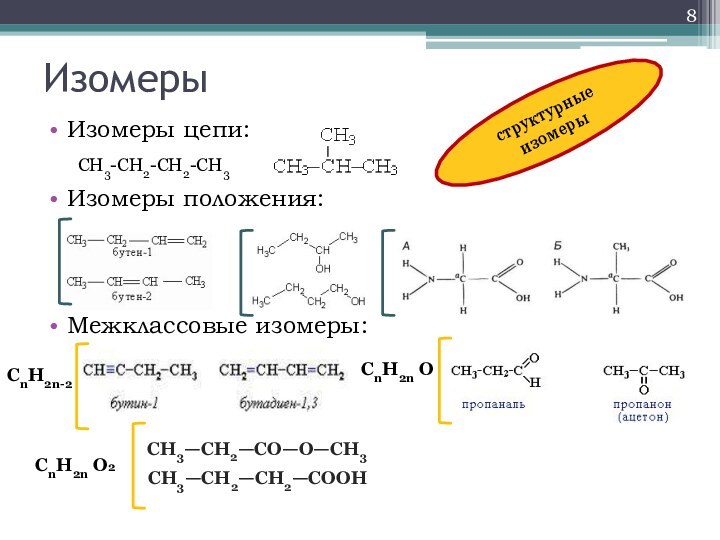
- 8. ИзомерыИзомеры цепи:Изомеры положения:Межклассовые изомеры:CH3-CH2-CH2-CH3СН3—СН2—СН2—СООНСН3—СН2—СО—О—СН3CnH2n-2CnH2n ОCnH2n О2структурные изомеры
- 9. Конформационные (“поворотные”)Конфигурационные:Энантиомеры (“зеркальные”) Диастереомеры σ—диастереомерия: π—диастереомерия (геометрическая изомерия):стереоизомерыСтереоизомеры
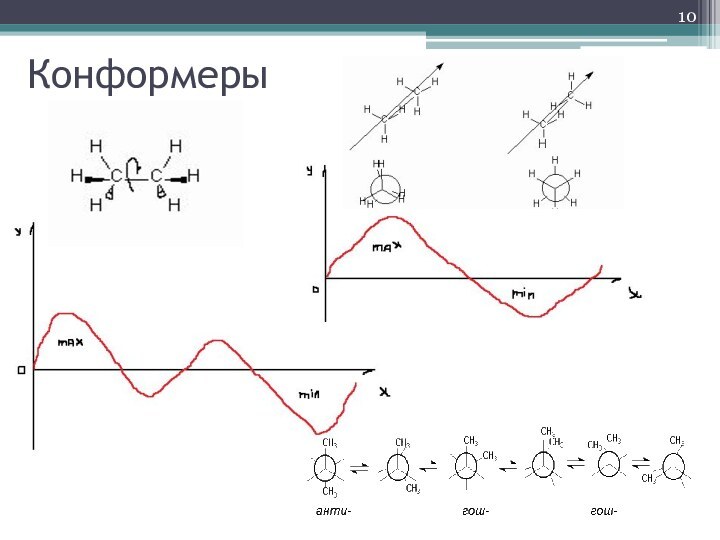
- 10. Конформеры
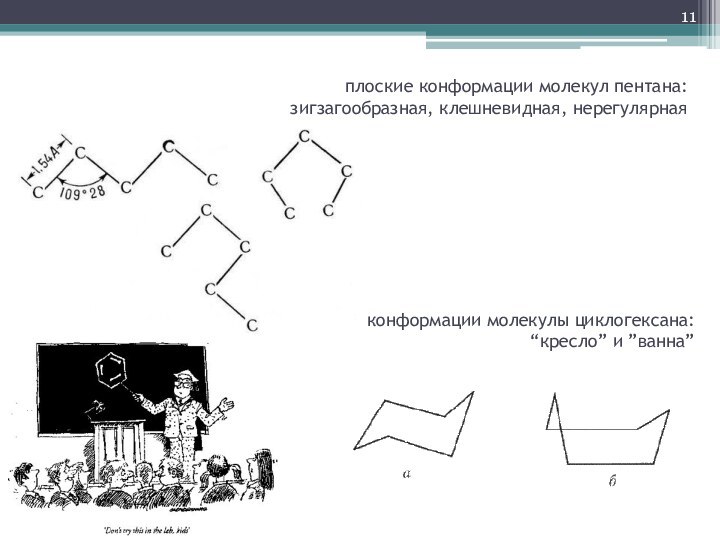
- 11. плоские конформации молекул пентана: зигзагообразная, клешневидная, нерегулярнаяконформации молекулы циклогексана: “кресло” и ”ванна”
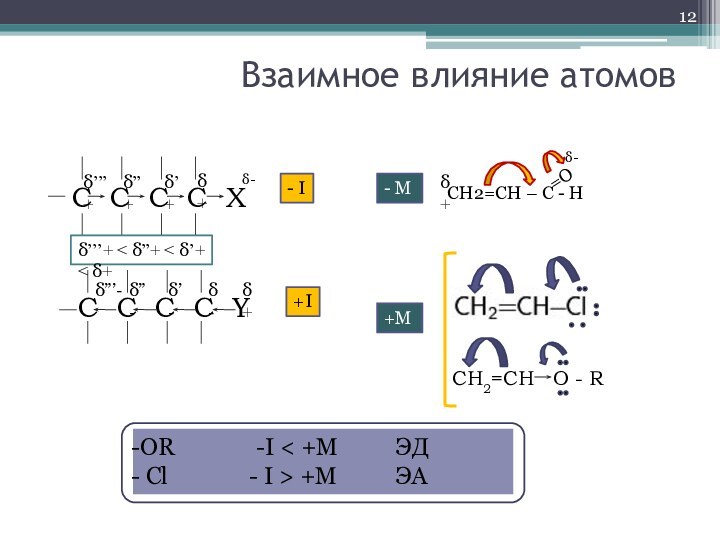
- 12. δ+Взаимное влияние атомов С C C
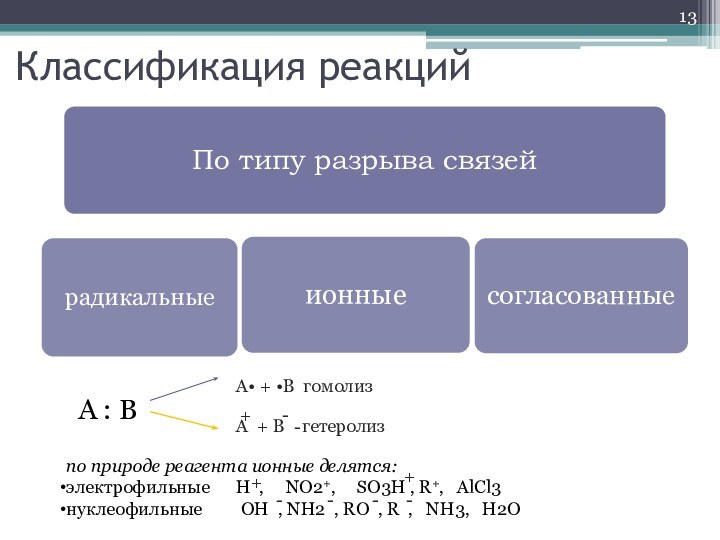
- 13. Классификация реакцийA : B A• + •B
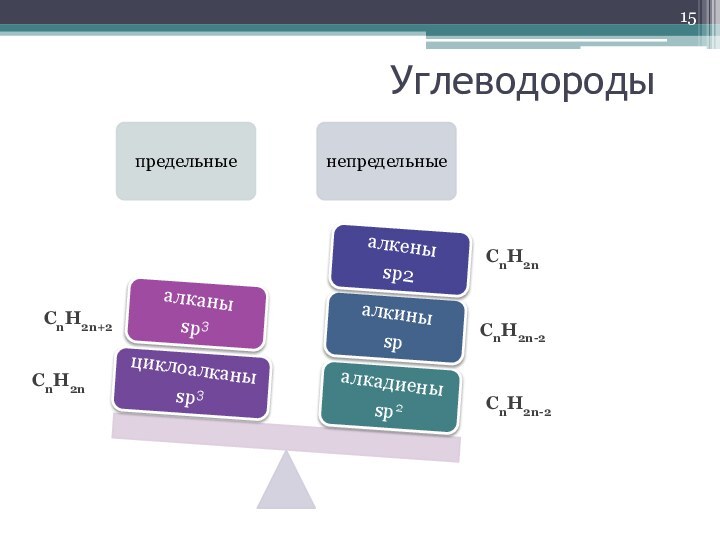
- 15. УглеводородыCnH2nCnH2n-2CnH2n-2CnH2nCnH2n+2
- 16. Механизм радикального замещения SR (sp³) инициирование ( T, hν, радиация)рост цепиобрыв цепи
- 17. + Cl2
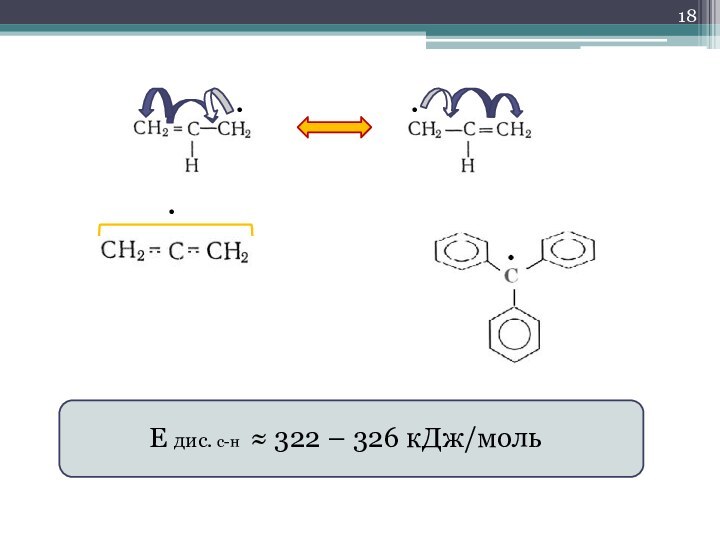
- 18. •••Е дис. с-н ≈ 322 – 326 кДж/моль
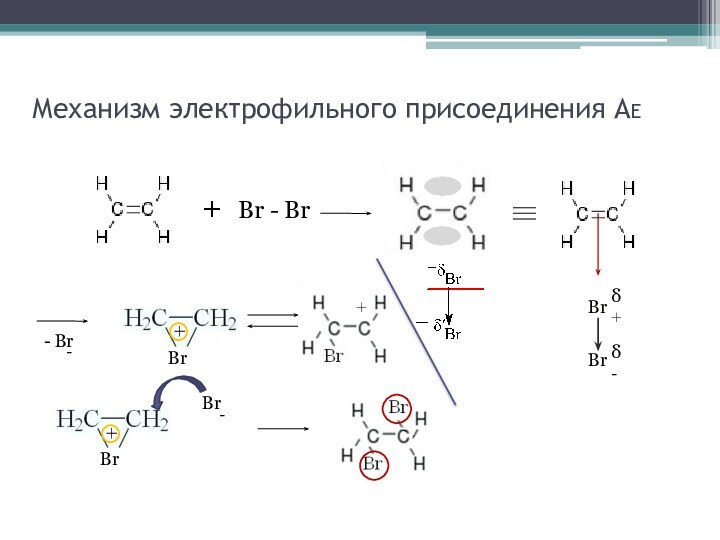
- 19. Механизм электрофильного присоединения АE+ Br - BrBrδ+- Br -Br++Br+Br -Brδ-
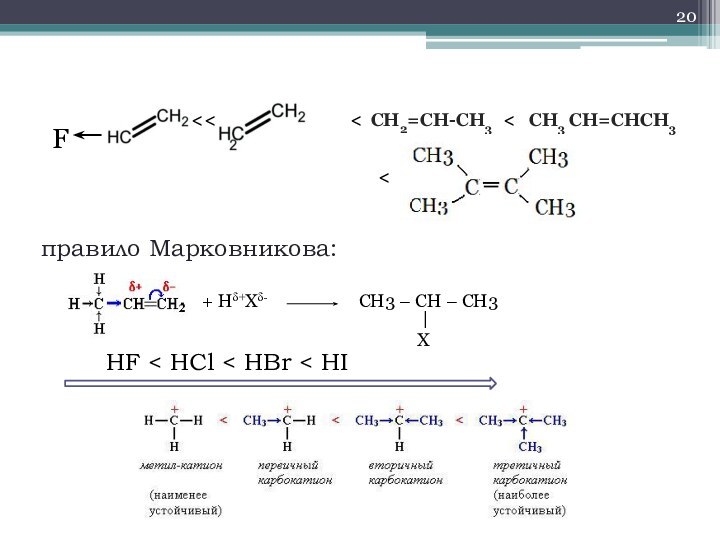
- 20. правило Марковникова:F
- 21. AR (против правила Марковникова)
- 22. AE (кислотный катализ)CH3 – CH = CH2
- 23. Окисление алкенов“мягкое” окисление“жесткое” окисление
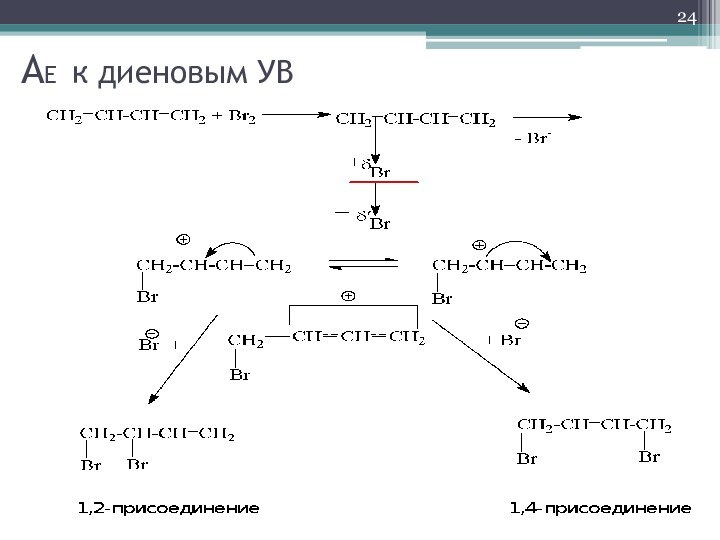
- 24. AE к диеновым УВ
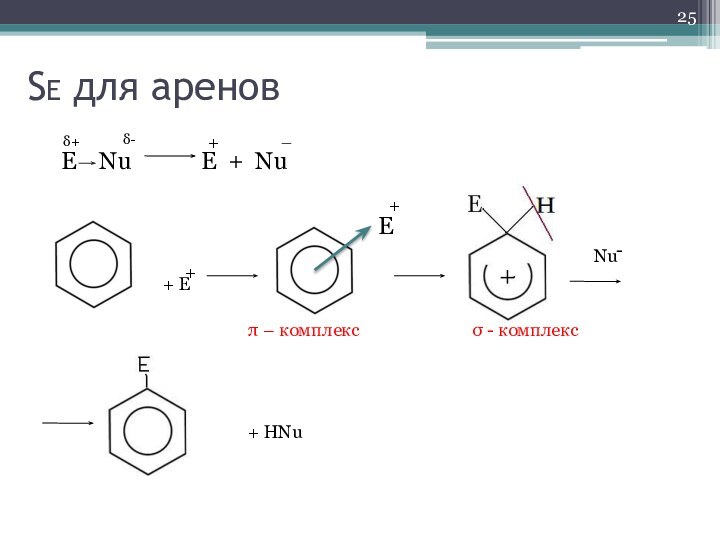
- 25. SE для ареновE Nu
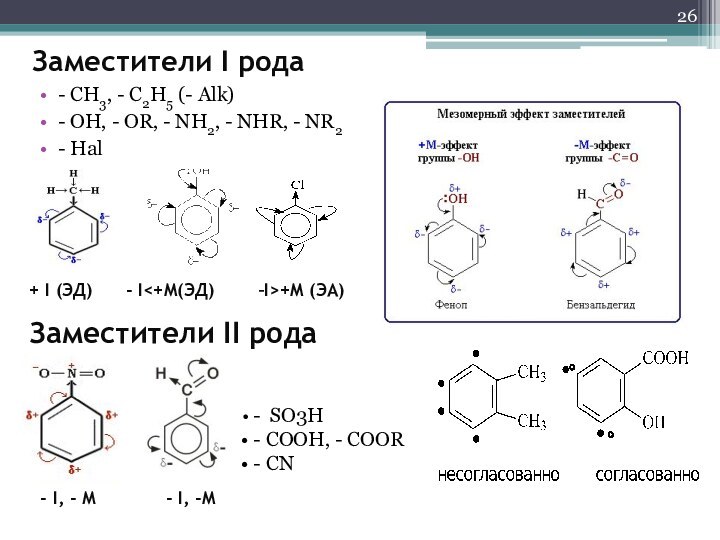
- 26. Заместители I рода- CH3, - C2H5 (-
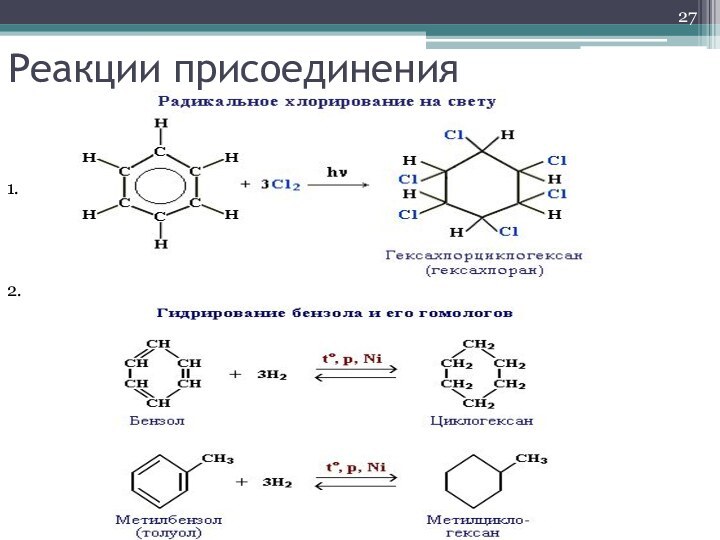
- 27. Реакции присоединения1.2.
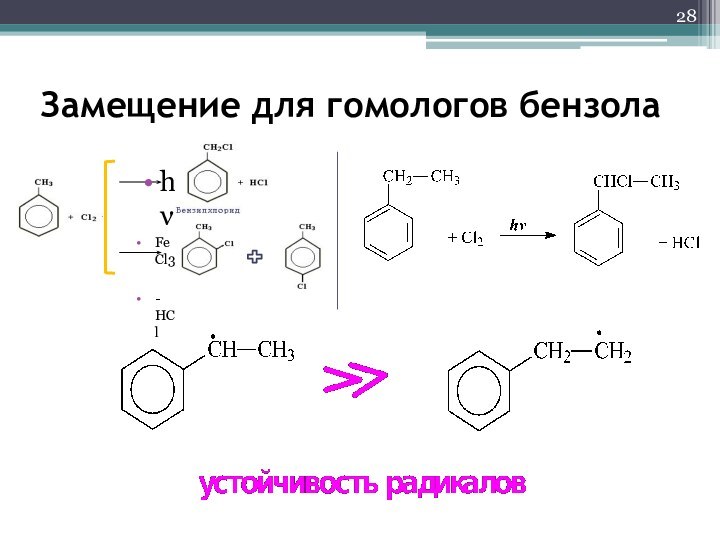
- 28. Замещение для гомологов бензола
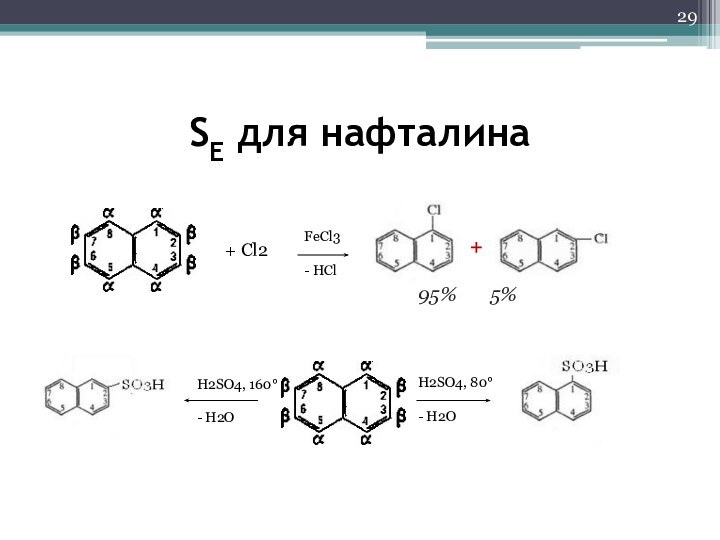
- 29. H2SO4, 80- H2OH2SO4, 160- H2OFeCl3- HCl+ Сl2+95% 5%SE для нафталина
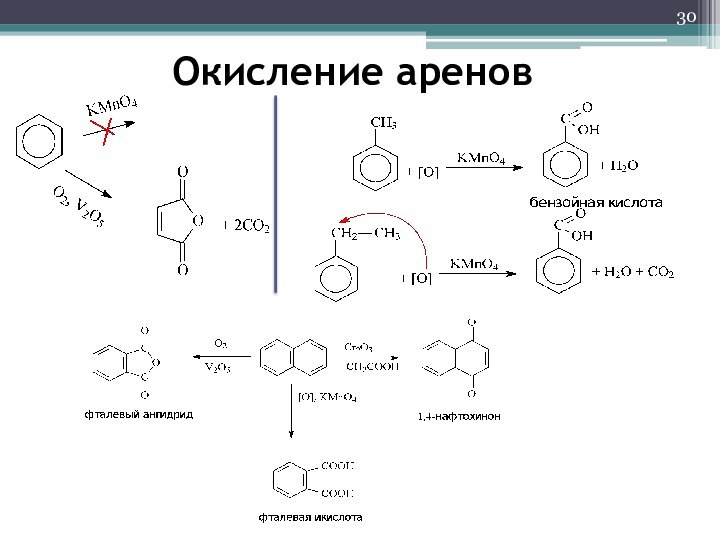
- 30. Окисление аренов
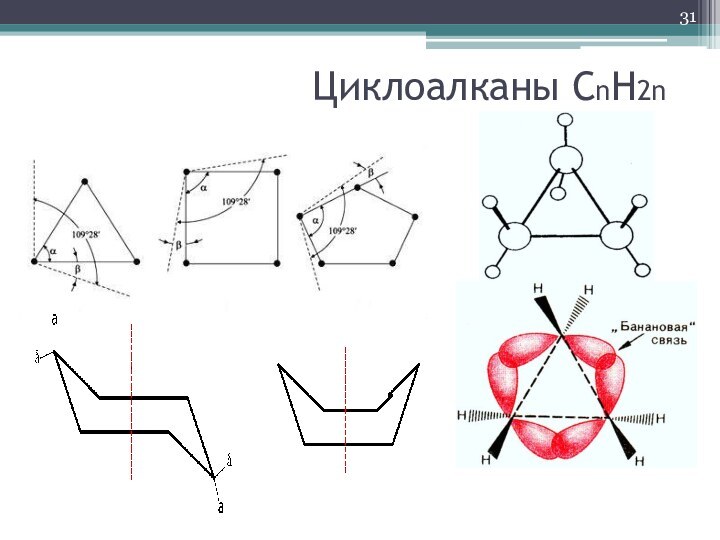
- 31. Циклоалканы СnH2n
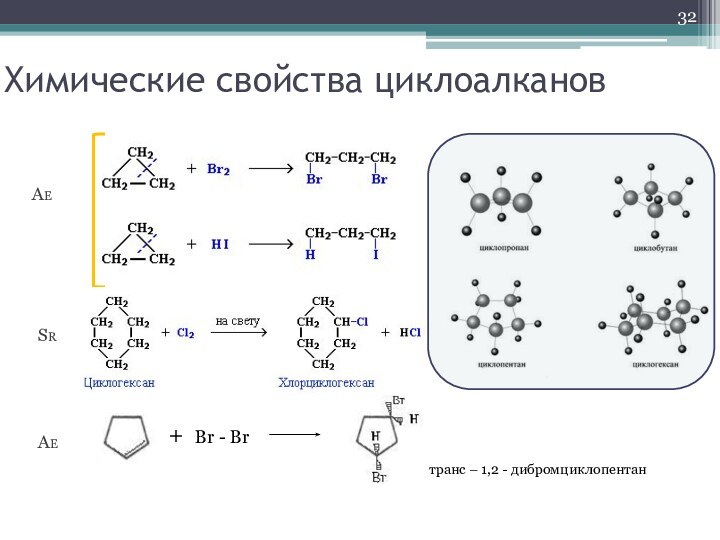
- 32. Химические свойства циклоалкановAESRAE+ Br - Brтранс – 1,2 - дибромциклопентан
- 33. Скачать презентацию
- 34. Похожие презентации
по углеродному скелету








Слайд 5
σ - связи
π - связи
Е с с
= 347 кДж/моль
Е с с = 606 кДж/моль
Е
с с = 828 кДж/моль+
+2
l = 0,154 нм
l = 0,133 нм
l = 0,12 нм
Слайд 7
Ароматичность
Е сопряжения ≈ 151 кДж/моль
4n + 2; n
= 0, 1, 2, 3 …
=
=
+
+
-
-
нафталин
антрацен
фенантрен
Слайд 8
Изомеры
Изомеры цепи:
Изомеры положения:
Межклассовые изомеры:
CH3-CH2-CH2-CH3
СН3—СН2—СН2—СООН
СН3—СН2—СО—О—СН3
CnH2n-2
CnH2n О
CnH2n О2
структурные изомеры
Слайд 9
Конформационные (“поворотные”)
Конфигурационные:
Энантиомеры (“зеркальные”)
Диастереомеры
σ—диастереомерия:
π—диастереомерия (геометрическая изомерия):
стереоизомеры
Стереоизомеры
Слайд 11
плоские конформации молекул пентана:
зигзагообразная, клешневидная, нерегулярная
конформации молекулы
циклогексана:
“кресло” и ”ванна”
Слайд 12
δ+
Взаимное влияние атомов
С C C C
X
C C C C Y
δ’’’+ < δ”+ < δ’+ < δ+
δ-
δ’+
δ”+
δ’’’+
- I
δ-
δ+
δ”’-
δ”-
δ’-
+I
- M
+M
CH2=CH – C - H
=O
δ-
δ+
CH2=CH O - R
OR -I < +M ЭД
Cl - I > +M ЭА
Слайд 13
Классификация реакций
A : B
A• + •B гомолиз
A
+ B гетеролиз
+
-
по природе реагента ионные делятся:
электрофильные
H , NO2+, SO3H , R+, AlCl3нуклеофильные OH , NH2 , RO , R , NH3, H2O
+
+
-
-
-
-
-
Слайд 16
Механизм радикального замещения SR (sp³)
инициирование ( T,
hν, радиация)
рост цепи
обрыв цепи
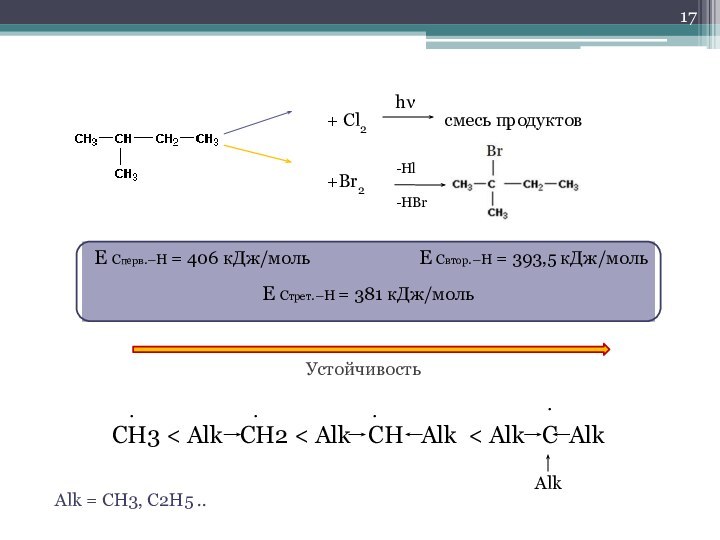
Слайд 17 + Cl2
смесь продуктов
hν
+Br2
Hl
HBr
Е Сперв.–Н = 406 кДж/моль E Cвтор.–Н = 393,5 кДж/моль
Е Стрет.–Н = 381 кДж/моль
Устойчивость
CH3 < Alk CH2 < Alk CH Alk < Alk C Alk
Alk
Alk = CH3, C2H5 ..
Слайд 22
AE (кислотный катализ)
CH3 – CH = CH2 +
H2O CH3
– CH(OH) – CH3H
+
CH3 – CH = CH2 + CH3 – CH – CH3
H
+
+
карбкатион
HOH
Слайд 26
Заместители I рода
- CH3, - C2H5 (- Alk)
-
OH, - OR, - NH2, - NHR, - NR2
-
HalЗаместители II рода
- SO3H
- COOH, - COOR
- CN
+ I (ЭД) - I<+M(ЭД) –I>+M (ЭА)
- I, - М - I, -M





























