- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Контрольно-разрешительная система обеспечения качества ЛС. Система государственной регистрации ЛС
Содержание
- 2. Государственное регулирование качества фармацевтической продукции - основное
- 3. Государственное регулирование качества фармацевтической продукции базируется на
- 4. Основная целью КРС - защита потребителей от
- 5. КРС действует на федеральном, межрегиональном, территориальном и
- 6. Глава 6 ФЗ №61 «Об обращении лекарственных
- 7. Приказ Минздравсоцразвития РФ от 30.10.2006 N 734
- 8. Значительная роль в формировании системы государственного обеспечения
- 9. Техническое регулирование - правовое регулирование отношений в
- 10. Ттехническое регулирование включает 3 главных элемента:установление, применение
- 11. Первый элемент реализуется через принятие и применение
- 12. Принципы технического регулированиянезависимость органов оценки соответствия качества,
- 13. Принципы технического регулирования (2)применение единых правил установления
- 14. Обязательные требования по качеству, безопасности и эффективности
- 15. Предусмотрено два вида технических регламентов — общие
- 17. В контексте ТР государственное регулирование оборота ЛС
- 18. Положения ТР направлены на обеспечение безопасности ЛС
- 19. При этом предусмотрен отказ от ряда используемых
- 20. ТР предусматривается использование принятых в международном сообществе
- 21. Закон «О техническом регулировании» меняет статус стандартизации.Стандартизация
- 22. Цель стандартизации в сфере лекарственного обращения -
- 23. Стандартизация основывается на следующих принципах:добровольное применение стандартов;
- 24. Как правило, процедура стандартизации включает 4 этапа:I
- 25. Итоговым документом стандартизации является нормативный документ, устанавливающий
- 26. Отличительные признаки технического регламента и стандарта на продукцию
- 27. В зависимости от сферы действия различают стандарты
- 28. Значительная роль в международных правилах обеспечения качества,
- 29. GMP (good manufacturing practice) — добротная производственная
- 30. Стандартизация ЛС заключается в разработке и использовании
- 31. Фармакопейная статья предприятия - документ отражает конкретную
- 32. Одним из основополагающих интернациональных стандартов является Международная
- 33. Оценка соответствия — прямое или косвенное определение
- 34. В оценке соответствия участвуют три группы лиц,
- 35. Подтверждение соответствия проводится в целях:удостоверения соответствия продукции
- 36. Подтверждение соответствия — документальное удостоверение соответствия продукции
- 37. В Российской Федерации подтверждение соответствия может носить добровольный или обязательный характер.
- 38. Сертификация — форма осуществления органом по сертификации
- 39. Порядок осуществления государственного контроля качества лекарственных
- 40. Приказ Минздравсоцразвития России от 26.08.2010 N 750н
- 41. Организация проведения экспертизы качества, эффективности и безопасности
- 42. Скачать презентацию
- 43. Похожие презентации
Государственное регулирование качества фармацевтической продукции - основное условие, определяющее функционирование фармацевтической отрасли.«Система качества фармацевтической продукции» - это комплекс мер по обеспечению эффективности и безопасности фармацевтических продуктов, а также их соответствия официальным требованиям стандартов качества.







































Слайд 2 Государственное регулирование качества фармацевтической продукции - основное условие,
определяющее функционирование фармацевтической отрасли.
комплекс мер по обеспечению эффективности и безопасности фармацевтических продуктов, а также их соответствия официальным требованиям стандартов качества.Слайд 3 Государственное регулирование качества фармацевтической продукции базируется на контрольно-разрешительной
системе (КРС), включающей комплекс мероприятий по обеспечению качества ЛС,
ИМН, медицинской техники, БАД, лечебно-профилактических средств, косметических и стоматологических товаров.Слайд 4 Основная целью КРС - защита потребителей от негативных
последствий применения ЛС, связанных с недостаточной изученностью на этапе
разрешения и внедрения в практику лекарственных средств, выпуском и ввозом в страну недоброкачественной продукции, нарушениями условий хранения и реализации.Слайд 5 КРС действует на федеральном, межрегиональном, территориальном и производственном
уровнях и базируется на основных направления:
экспертиза и регистрация
ЛС; декларирование соответствия ЛС;
контроль качества, эффективности, безопасности ЛС.
Слайд 6 Глава 6 ФЗ №61 «Об обращении лекарственных средств»
(2011 г.).
Статья 13. Государственная регистрация лекарственных препаратов
1. Лекарственные препараты
вводятся в гражданский оборот на территории РФ, если они зарегистрированы соответствующим уполномоченным федеральным органом исполнительной власти.2. Государственной регистрации подлежат:
1) оригинальные лекарственные препараты;
2) воспроизведенные лекарственные препараты;
3) новые комбинации зарегистрированных ранее лекарственных препаратов;
4) лекарственные препараты, зарегистрированные ранее, но произведенные в других лекарственных формах, в новой дозировке.
Основные требования к разработке, доклиническим и клиническим исследованиям лекарственных средств определены в ФЗ №61 (глава 5).
Слайд 7 Приказ Минздравсоцразвития РФ от 30.10.2006 N 734 "Об утверждении
Административного регламента Федеральной службы по надзору в сфере здравоохранения
и социального развития по исполнению государственной функции по организации проведения экспертизы качества, эффективности и безопасности лекарственных средств" (Зарегистрировано в Минюсте РФ 30.11.2006 N 8541)Слайд 8 Значительная роль в формировании системы государственного обеспечения качества
и безопасности фармпродукции в РФ отводится реализации положений закона
№184-ФЗ «О техническом регулировании» (от 27.12.02 г., введен в действие с 1 июля 2003 г.; с изм. и доп., вступающими в силу с 01.09.2013)Слайд 9 Техническое регулирование - правовое регулирование отношений в области
установления, применения и исполнения обязательных требований к продукции или
к процессам проектирования продукции, производства, строительства, монтажа, наладки, эксплуатации, хранения, перевозки, реализации и утилизации, а также в области установления и применения на добровольной основе требований к продукции и вышеназванным процессам.
Слайд 10
Ттехническое регулирование включает 3 главных элемента:
установление, применение и
исполнение обязательных требований к продукции и процессам производства, эксплуатации,
хранения, перевозки, реализации и утилизации;установление и применение на добровольной основе требований к продукции и названным процессам;
правовое регулирование в области оценки соответствия.
Слайд 11 Первый элемент реализуется через принятие и применение технических
регламентов на фармацевтическую продукцию и процессы ее обращения;
второй —
через стандартизацию; третий — через оценку соответствия посредством процедур сертификации и декларирования соответствия, государственного контроля и надзора, аккредитации, испытаний (например, доклинических и клинических), регистрации.
Слайд 12
Принципы технического регулирования
независимость органов оценки соответствия качества, а
также субъектов технического регулирования, в том числе финансовая (недопустимость
внебюджетного финансирования государственного контроля за соблюдением технических регламентов), от изготовителей, исполнителей и приобретателей (покупателей и заказчиков);недопустимость совмещения одним органом полномочий на аккредитацию и сертификацию; соединения полномочий органа государственного контроля и органа по сертификации; ограничения конкуренции при осуществлении аккредитации и сертификации;
Слайд 13
Принципы технического регулирования (2)
применение единых правил установления требований
к продукции и процессам ее обращения;
единство правил и
методов исследований (испытаний) и измерений при проведении процедур обязательной оценки соответствия; системы и правил аккредитации; применения технических регламентов независимо от видов и особенностей сделок; соответствие технического регулирования уровню развития национальной экономики, материально-технической базы, науки и технологий.
Слайд 14 Обязательные требования по качеству, безопасности и эффективности продукции,
разрабатываемые на основе контроля выделяемых проб, отражаются в техническом
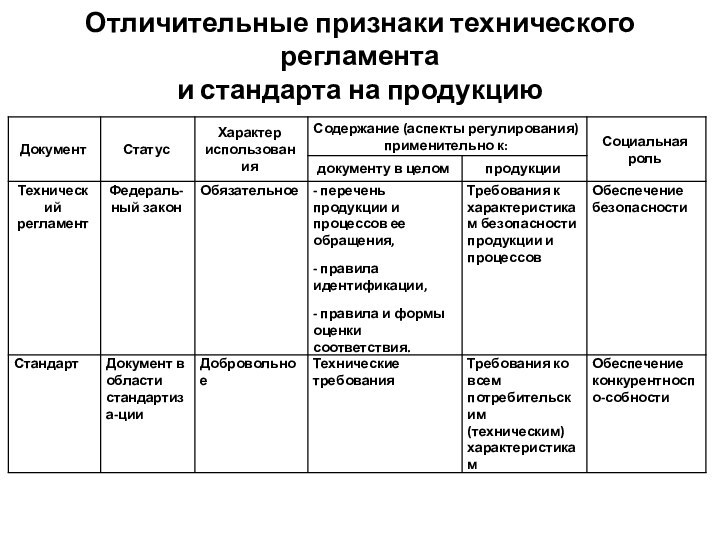
регламенте.Технический регламент — документ, который принят международным договором РФ, ратифицированным в порядке, установленном законодательством РФ, или Федеральным законом, или указом Президента Российской Федерации, или постановлением Правительства РФ и утверждает обязательные для применения и исполнения требования к объектам технического регулирования.
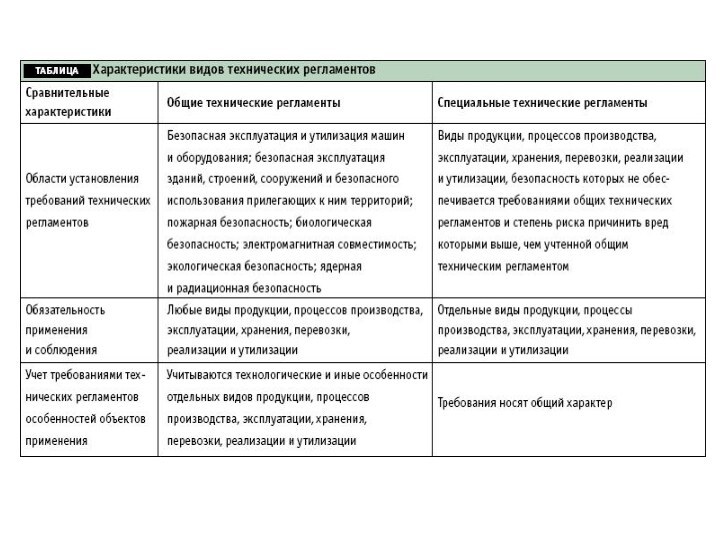
Слайд 15 Предусмотрено два вида технических регламентов — общие (OTP)
и специальные (СТР).
Требования OTP обязательны для применения и
соблюдения в отношении любых видов продукции и процессов их движения, так как эти регламенты касаются вопросов безопасности (ядерной, радиационной, пожарной, биологической, экологической и др.). Требования СТР учитывают технологические и иные особенности отдельных видов продукции и процессов, чтобы исключить любую степень риска.
Слайд 17 В контексте ТР государственное регулирование оборота ЛС должно
осуществляться в соответствии со следующими принципами:
применение единых требований к
ЛС вне зависимости от страны их происхождения; гармонизация с международными требованиями и подходами к регулированию, в т. ч. при разработке и применении национальных стандартов;
недопустимость создания неоправданных препятствий для развития производства ЛС и торговли ими как в пределах РФ, так и во внешней торговле;
свободный выбор субъектами оборота ЛС, путей достижения необходимого уровня безопасности и эффективности ЛС, установленных требованиями настоящего закона;
недопустимость проведения повторных исследований ЛС на людях или животных, за исключением случаев, когда в этом есть особая необходимость.
Слайд 18 Положения ТР направлены на обеспечение безопасности ЛС для
потребителя (при их использовании по назначению) на всех этапах
жизненного цикла готовых ЛП:разработка (доклинические и клинические исследования), допуск на рынок (государственная регистрация), производство, хранение и транспортировка, оптовая торговля, розничная реализация, утилизация (уничтожение).
Для этого предусматривается использование принятых в международном сообществе форм и методов оценки соответствия лекарственной продукции.
Слайд 19 При этом предусмотрен отказ от ряда используемых до
принятия ТР форм подтверждения соответствия (обязательной сертификации, регистрации фармацевтических
субстанций и т.д.), что позволит снизить издержки производителей, импортеров и продавцов, но не окажет негативного воздействия на уровень безопасности.Слайд 20 ТР предусматривается использование принятых в международном сообществе форм
и методов оценки соответствия лекарственной продукции:
регистрация как одна
из ключевых форм, испытания, государственный контроль (надзор) за различными этапами обращения ЛС, подтверждение соответствия самим производителем в форме декларирования соответствия.
Слайд 21
Закон «О техническом регулировании» меняет статус стандартизации.
Стандартизация —
деятельность по установлению правил и характеристик в целях их
добровольного многократного использования, направленная на достижение упорядоченности в сферах производства и обращения продукции и повышение ее конкурентоспособности.Слайд 22 Цель стандартизации в сфере лекарственного обращения - защита
качества фармацевтической продукции, процессов ее производства, продвижения, хранения, уничтожения
и др.Она направлена на обеспечение фармакологической, экологической, технологической безопасности, рациональное использование ресурсов.
Слайд 23
Стандартизация основывается на следующих принципах:
добровольное применение стандартов;
максимальный
учет при разработке стандартов законных интересов заинтересованных лиц;
применение
международного стандарта как основы разработки национального стандарта; недопустимость создания препятствий производству и обращению продукции, выполнению работ и оказанию услуг, в большей степени, чем это установлено целями стандартизации;
недопустимость установления таких стандартов, которые противоречат техническим регламентам;
обеспечение условий для единообразного применения стандартов.
Слайд 24
Как правило, процедура стандартизации включает 4 этапа:
I —
выбор объектов стандартизации, в число которых могут входить продукты
(отдельные аспекты однородных групп — термины, обозначения, технические требования, методы контроля, правила приемки, маркировки, упаковки, транспортировки и хранения), услуги, а также процессы их обращения;II — описание объекта с учетом основных требований, т.е. его моделирование;
III — оптимизация модели путем унификации объекта стандартизации с использованием методов систематизации, типизации, симплификации (выявление нецелесообразных объектов) и др.;
IV — стандартизация модели — разработка нормативного документа на базе унифицированной модели.
Слайд 25 Итоговым документом стандартизации является нормативный документ, устанавливающий правила,
общие принципы или характеристики, касающиеся различных видов деятельности или
их результатов.Термин «нормативный документ» является родовым и охватывает такие понятия, как стандарты и иные нормативные документы по стандартизации: правила, рекомендации, кодексы установившейся практики, общероссийские классификаторы.
Стандарт может содержать требования к терминологии, символике, упаковке, маркировке или этикеткам и правилам их нанесения.
Слайд 27 В зависимости от сферы действия различают стандарты разного
статуса, или категории:
международный, принятый международной организацией;
межгосударственный, действующий не только
на территории РФ и СНГ);национальный, утвержденный национальным органом РФ по стандартизации;
государственный (например, государственный образовательный стандарт);
региональный;
стандарт предприятия.
Слайд 28 Значительная роль в международных правилах обеспечения качества, эффективности
и безопасности лекарственных средств отводится системе GXP, которая представляет
собой свод правил добротной практики, состоящий из:GLP (good laboratory practice) — добротная лабораторная практика, целью которой является получение надежной воспроизводимой информации об эффективности и безопасности создаваемых лекарств на экспериментальных моделях;
GCP (good clinical practice) — добротная клиническая практика, соблюдение которой необходимо при клинических испытаниях новых ЛС и технологий их использования, проводимых с целью характеристики эффективности и безопасности изучаемых фармакологических средств в клинике человека, выявления преимуществ этих средств и рекомендации их для промышленного производства;
Слайд 29 GMP (good manufacturing practice) — добротная производственная практика,
обеспечивающая получение лекарственных веществ, препаратов и готовых к использованию
и введению в организм человека JIC, соответствующих всем показателям качества, предусмотренным нормативно-технической документацией на эту продукцию;GDP (good distribution practice) — правила добротной дистрибьюции. Цель их — обеспечить продвижение выпускаемых фармацевтических товаров к их институциональным, оптовым и промежуточным потребителям;
GPP (good pharmacy practice) — правила добротной аптечной практики. Их цель — организация обеспечения населения (покупателей), амбулаторных и стационарных больных всеми товарами аптечного ассортимента и оказания научно-консультативной помощи по выбору, использованию JIC в различных клинических ситуациях и др. Этими правилами установлено, что руководить аптекой могут лишь лица, имеющие фармацевтическое образование;
GPrP — добротная приобретательская практика, организационные принципы надлежащей закупки лекарств.
Слайд 30 Стандартизация ЛС заключается в разработке и использовании единых
норм, правил, требований при поиске, создании, внедрении в промышленное
производство и медицинскую практику лекарственных, профилактических, диагностических средств и медицинских иммунобиологических препаратов. Стандартизация проводится с учетом новейших достижений науки и техники, передового опыта лечебных, санитарно-эпидемиологических, научно-исследовательских, аптечных и других организаций системы здравоохранения, а также предприятий химико-фармацевтической промышленности. Результаты стандартизации лекарственных средств находят свое отражение в специальных нормативных документах — фармакопейных статьях.Слайд 31 Фармакопейная статья предприятия - документ отражает конкретную технологию
конкретного предприятия при изготовлении конкретной продукции, прошедшей экспертизу и
государственную регистрацию.Требования ФСП на лекарственное сырье должны быть не ниже требований Фармакопейной Статьи, при этом производитель несет ответственность за то, что реализуемая им продукция в течение всего заявленного срока годности отвечает всем требованиям Государственного стандарта качества лекарственного средства.
Слайд 32 Одним из основополагающих интернациональных стандартов является Международная Фармакопея,
которая устанавливает приемлемые стандарты действенности, чистоты и качества фармацевтических
продуктов, поступающих на международный рынок. Эти стандарты в соответствии с уставом ВОЗ доступны для принятия странами — членами этой международной организации.Слайд 33 Оценка соответствия — прямое или косвенное определение соблюдения
требований, предъявляемых к объекту.
К способам прямого определения относятся методы
измерения, испытания, тестирования, обследования и др. Способом косвенного определения соблюдения требований, предъявляемых к объекту, может быть, например, документальная экспертиза.Слайд 34 В оценке соответствия участвуют три группы лиц, которые
представляют две заинтересованные стороны (например, поставщик и покупатель) и
независимую -лицо или орган, выступающий в качестве арбитра.Основными видами деятельности при оценке соответствия являются подтверждение соответствия, регистрация, аккредитация, контроль и надзор и пр.
Слайд 35
Подтверждение соответствия проводится в целях:
удостоверения соответствия продукции (работ,
услуг или иных объектов), процессов производства, эксплуатации, хранения, перевозки,
реализации и утилизации, работ, услуг или иных объектов техническим регламентам, стандартам, условиям договоров;содействия потребителям в компетентном выборе продукции (работ, услуг);
повышения конкурентоспособности продукции (работ, услуг);
создания условий для обеспечения свободного перемещения товаров по территории страны, а также для осуществления международного экономического, научно-технического сотрудничества и международной торговли.
Слайд 36 Подтверждение соответствия — документальное удостоверение соответствия продукции или
иных объектов, процессов производства, эксплуатации, хранения, перевозки, реализации и
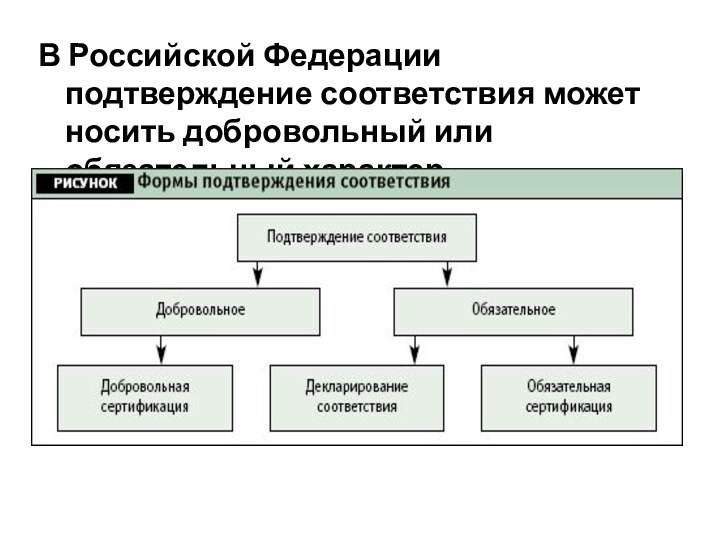
утилизации, выполнения работ или оказания услуг требованиям технических регламентов, положениям стандартов или условиям договоров.Слайд 37 В Российской Федерации подтверждение соответствия может носить добровольный
или обязательный характер.
Слайд 38 Сертификация — форма осуществления органом по сертификации подтверждения
соответствия объектов требованиям технических регламентов, положениям стандартов или условиям
договоров.Декларирование соответствия — форма подтверждения соответствия продукции требованиям технических регламентов.
При сертификации подтверждение соответствия осуществляется независимой стороной — органом по сертификации, в отличие от декларирования соответствия, которое проводит производитель или поставщик.
Слайд 39
Порядок осуществления государственного контроля качества лекарственных средств
Государственный контроль
качества, эффективности и безопасности лекарственных средств осуществляется на федеральном,
межрегиональном, региональном, территориальном и производственном уровнях.Слайд 40 Приказ Минздравсоцразвития России от 26.08.2010 N 750н (ред. от
13.12.2012) "Об утверждении правил проведения экспертизы лекарственных средств для медицинского
применения и формы заключения комиссии экспертов" (Зарегистрировано в Минюсте России 31.08.2010 N 18315)Слайд 41 Организация проведения экспертизы качества, эффективности и безопасности лекарственных
средств включает в себя административные процедуры:
организация проведения экспертизы качества,
эффективности и безопасности, осуществляемой при регистрации ЛС,осуществление сбора и анализа информации о побочных эффектах применения ЛС,
организация проведения экспертизы качества при осуществлении предварительного государственного контроля ЛС. Осуществляется для впервые производимых и впервые ввозимых на территорию РФ ЛС; для ЛС, выпускаемых по измененной технологии; для ЛС, выпускаемых после перерыва производства данного ЛС от трех лет и более; для иных ЛС вследствие выявления ухудшения их качества;