- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему КОРРОЗИЯ МЕТАЛЛОВ
Содержание
- 2. Коррозия – это самопроизвольный процесс разрушения металлов
- 3. Меn+ + nе- Мео (G
- 4. КОРРОЗИЯхимическаяэлектрохимическаябиологическаяКлассификация коррозионных процессов.
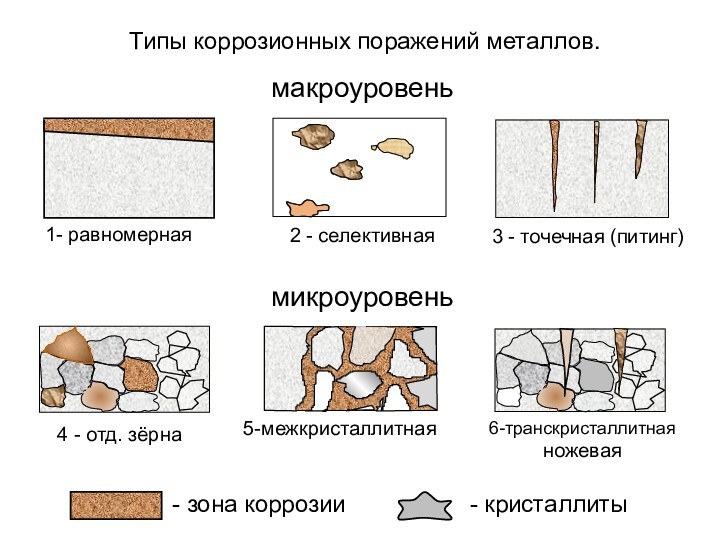
- 5. - зона коррозии- кристаллиты1- равномерная2 -
- 6. ХИМИЧЕСКАЯ КОРРОЗИЯ Химическая коррозия – это самопроизвольное разрушение
- 7. Продуктами коррозии могут быть оксиды, хлориды, сульфиды,
- 8. Различают жаростойкость и жаропрочность металлов. Жаростойкость –
- 9. Коррозия в жидкостях - неэлектролитах. К неэлектролитам
- 10. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯвозникает при соприкосновении металла с электропроводящей
- 11. Причиной образования короткозамкнутых микро-ГЭ в металле, кроме
- 12. На аноде происходит окисление и растворение металла
- 13. Водородная деполяризация – с восстановлением водорода.в
- 14. При водородной деполяризации эл.хим.коррозии могут подвергаться металлы
- 15. МЕХАНИЗМЫ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИПри эл.хим.коррозии металлов выделяют четыре
- 16. К[Cu]: 2Н+ + 2e- Н2А: Fe0-
- 17. 2. Контакт с продуктом коррозии. Fe(OH)2РастворАнод (–)
- 18. или Fe0 - 2e- Fe2+,
- 19. 4. Коррозия под мех. напряжением. Статические механ.
- 20. растяжениесжатие4. Коррозия под механ. напряжениемножевая или транскристаллитная
- 21. P+растяжениесжатиеφсжат > φрастяж4. Коррозия под механ.
- 22. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИлегирование металловзащитные покрытияэлектрохимичес-кая защитаобработка коррозионной средыметаллическиенеметалли-ческиехимическиевнешним токомпротекторнаяалитированиехромированиеметод окунания
- 23. Катодное покрытие – это покрытие менее активным
- 24. Анодное покрытие – это покрытие более активным
- 25. Протекторная защита ехр., трубопровода во влажном грунте.
- 26. Защита внешним током или катодная защита –
- 28. Скачать презентацию
- 29. Похожие презентации














![КОРРОЗИЯ МЕТАЛЛОВ К[Cu]: 2Н+ + 2e- Н2А: Fe0- 2e-Fe2+ 4Fe(OH)2 + 2H2O +](/img/tmb/14/1322722/a660797ed5aa7e3c502d77fa82b8a429-720x.jpg)











Слайд 3 Меn+ + nе- Мео (G O)
металлургия
Коррозия протекает с ум-нием эн. Гиббса:
Мео -
ne- Меn+ (G 0) коррозияОсновной причиной корроз. разрушения металлов и сплавов является их термодинамическая неустойчивость.
Слайд 5
- зона коррозии
- кристаллиты
1- равномерная
2 - селективная
3
- точечная (питинг)
5-межкристаллитная
6-транскристаллитная
ножевая
4 - отд. зёрна
Типы коррозионных поражений металлов.
макроуровень
микроуровень
Слайд 6
ХИМИЧЕСКАЯ КОРРОЗИЯ
Химическая коррозия – это самопроизвольное разрушение металлов
под действием окислителей-неэл-тов, обычно газов и орг. жидкостей, не
проводящих эл. ток.Различают газовую коррозию и коррозию в жидких неэлектролитах.
Газовая коррозия – это разрушение металла при контакте с сухими газами при высоких т-рах. Она имеет место при работе двигателей внутреннего сгорания, при хим. обработке металлов, горячей прокатке, ковке, в энергетических установках и др. При газовой коррозии происходит химическое взаимодействие металла с активными средами (CO2; H2S; O2; SO2; галогенами).
Слайд 7
Продуктами коррозии могут быть оксиды, хлориды, сульфиды, например:
4Fe
+ 3O2 2Fe2O3;
2Al + 3Cl2 2AlCl3;
4Ag +
O2 + H2S 2Ag2S + 2H2O.O2
O2
O2
O2
металл
металл
МеxOy
МеxOy
Влияние характера оксидной плёнки
Слайд 8
Различают жаростойкость и жаропрочность металлов.
Жаростойкость – это
устойчивость металлических материалов к коррозии при высоких температурах в
окислительной атмосфере,Жаропрочность – это способность сохранять прочность при высоких температурах в инертной атмосфере.
Слайд 9
Коррозия в жидкостях - неэлектролитах.
К неэлектролитам (непроводящим
эл. ток) относятся жидкости орг. происхождения – спирты, бензол,
хлороформ, керосин, нефть, бензин и др., а также ряд жидкостей неорг. происхождения – расплавленная сера, жидкий бром и др. В чистом виде орг. жидкости практически не реагируют с металлами, но в присутствии даже незначительного кол-ва примесей процессы взаимодействия резко усиливаются. Ускоряет коррозионные процессы наличие серосодержащих в-в, растворённого кислорода, повышение т-ры. Несмотря на сложность коррозионных процессов, в принципе они представляют собой обычные гетерогенные химические реакции:а) 2R - Cl + Me MeCl2 + R - R
S + Me MeS + R1 – R2
R2
б) R1
где R - органический радикал.
Слайд 10
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
возникает при соприкосновении металла с электропроводящей средой
(водой, водн. р-рами солей, кислот, щелочей; расплавленными солями и
щелочами). Разрушение металла происходит за счет образования на поверхности металла микро-гальванических элементов.Причины: наличие в основном металле примесей др. металлов или неметаллов, что приводит к появлению разности элект. потенциалов в местах их контакта и возникновению микротока. Участки относительно чистого металла поляризуются анодно, а примеси – катодно.
Слайд 11 Причиной образования короткозамкнутых микро-ГЭ в металле, кроме примесей,
может быть любая энергетическая неоднородность его пов-сти, вызванная неоднородностью
хим. или фаз. состава как самого металла, так и окружающей его коррозионной среды, а также мех. состояния металла.Наличие энергетической неоднородности на соседних участках металл. пов-сти приводит к тому, что участок с более отрицательным электродным потенциалом становится анодом, а
с более положительным – катодом.
Слайд 12 На аноде происходит окисление и растворение металла по
схеме:
(−)А: Me0 – nе- Men+
На катоде протекает
восстановлениев виде одного из двух процессов :
водородной иЛИ кислородной деполяризации.
Слайд 13
Водородная деполяризация –
с восстановлением водорода.
в кислой среде:
(+)К: 2Н+ + 2е- = Н20; (Н+/Н20)=−0,059рН ;
в
нейтральной или щелочной среде:(+)К: Н2О + 2е- = Н20 + 2ОН−;
(Н2О/Н20)=−0,059рН.
протекает при ограниченном доступе кислорода. Ех., под толстым слоём воды или в кислых р-рах, в к-рых растворимость кислорода очень низка.
Слайд 14 При водородной деполяризации эл.хим.коррозии могут подвергаться металлы с
электродным потенциалом более отрицательным, чем у водородного электрода в
соответствующей среде (или активные металлы, расположенные в ряду напряжений слева от водорода).При кислородной деполяризации коррозии могут подвергаться и неактивные металлы вплоть до серебра (0 Ag+/Ag = 0,8 B).
Кислородная деполяризация
с восстановлением атмосферного кислорода, растворённого в коррозионной среде
протекает по схеме:
(+)К: О2 + 2Н2О + 4e- = 4OH−;
(О2/Н2О) = +1,23 − 0,059рН
Слайд 15
МЕХАНИЗМЫ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
При эл.хим.коррозии металлов выделяют четыре механизма,
вызывающих образование и работу короткозамкнутых микро-ГЭ в результате:
1) контакта
двух разных металлов;2) контакта металла с продуктом коррозии;
3) разной конц-ции ок-ля на пов-сти металла;
4) изменения электродного потенциала металла под действием механических напряжений.
Как особый случай рассматривается коррозия под действием блуждающих токов.
Слайд 16
К[Cu]: 2Н+ + 2e- Н2
А: Fe0- 2e-Fe2+
4Fe(OH)2 + 2H2O + O2 4Fe(OH)3
Fe2+ + 2H2O
→ Fe(OH)2Fe(ОН)3 FeOOH + Н2О.
0 Fe/Fe2+= − 0,44B, 0 Сu/Cu2+= +0,34B
1. контакт двух металлов.
0 Fe/Fe2+= − 0,44B
0 Сu/Cu2+= +0,34B
Слайд 17
2. Контакт с продуктом коррозии.
Fe(OH)2
Раствор
Анод (–)
Fe
Катод (+)
-e¯
Fe(OH)2
H2↑
А: Fe0-
2e-Fe2+ (+) К[Fe(OH)2]: Н2О + 2е- = Н20 + 2ОН−
Fe2+
Fe(OH)2
Слайд 18 или Fe0 - 2e- Fe2+,
Fe2+ +2OH- Fe(OH)2,
4Fe(OH)2 + O2 +2H2O 4Fe(OH)3.
[O2]I
> [O2]II (О2/Н2О) = +1,23 + 0,03lg[O2] − 0,059рН
на катоде (+)К:
О2 + 2Н2О + 4е- 4ОН-
на аноде (−)А:
Fe0 - 3e- Fe3+,
Fe3+ +3OH- Fe(OH)3,
3) разная конц-ция ок-ля на пов-сти металла
φI > φII
Слайд 19
4. Коррозия под мех. напряжением.
Статические механ. напряжения
могут понижать термодинамическую устойчивость металла, разрушать защитные пленки. При
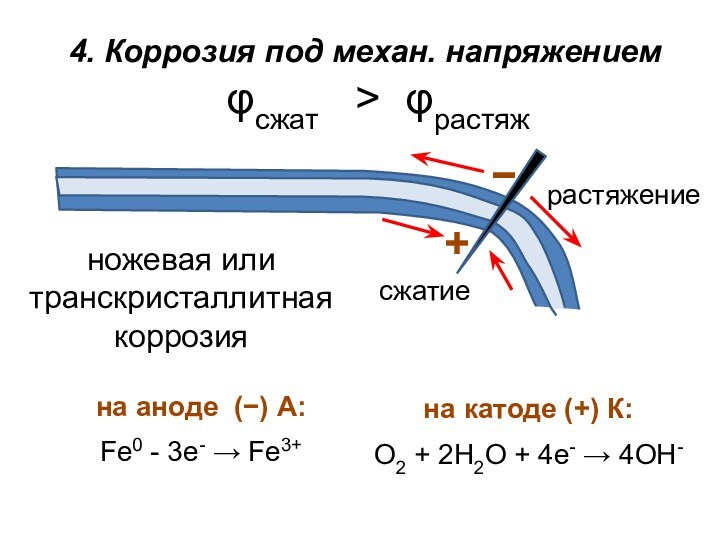
их неравномерном распределении сжатые области крист. решетки металлов вследствие перераспре-деления электронов, заряжаются положительно, а растянутые – отрицательно. При одноврем. воздействии коррозионной среды и механических напряжений происходит растрескивание металла (или ножевая коррозия) – один из наиболее опасных видов коррозионного разрушения.
Слайд 20
растяжение
сжатие
4. Коррозия под механ. напряжением
ножевая или транскристаллитная коррозия
φсжат
> φрастяж
на аноде (−) А:
Fe0 - 3e-
Fe3+на катоде (+) К:
О2 + 2Н2О + 4е- 4ОН-
−
+
Слайд 21
P
+
растяжение
сжатие
φсжат > φрастяж
4. Коррозия под механ. напряжением
ножевая
или транскристаллитная коррозия
на аноде (−) А:
Fe0 - 3e-
Fe3+на катоде (+) К:
О2 + 2Н2О + 4е- 4ОН-
Слайд 22
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
легирование металлов
защитные покрытия
электрохимичес-кая защита
обработка коррозионной
среды
металлические
неметалли-ческие
химические
внешним током
протекторная
алитирование
хромирование
метод окунания
Слайд 23 Катодное покрытие – это покрытие менее активным металлом.
ехр: Sn на Fe (луженое железо). Тип покрытия легко
определяется при нарушении его целостности. При наличии плёнки влаги образуется гальваническая пара, в к-рой анодом явл-ся более акт. металл – железо, а катодом – менее акт. металл (олово – покрытие). Более акт. металл – железо - будет окисляться, корродировать, а на менее акт. металле – олове - будут идти процессы восстановления.К[Sn]: 2H+ + 2 e- H20 (pH 7); H2O + O2 + 4 e- 4 OH- (pH = 7)
Принцип защиты основан на том, что менее активный металл более стоек к коррозии, и пока он сохраняет целостность, основной металл защищён от коррозионно-активной среды. В местах нарушения покрытия защищаемый металл будет подвергаться коррозии.
А[Fe]: Fe0 - 2 e- Fe2+
Fe2+ + 2 OH- Fe(OH)2
4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
Слайд 24 Анодное покрытие – это покрытие более активным металлом,
ехр, железо - цинком (оцинкованное железо) .
При нарушении целостности
покрытия в образовавшемся ГЭ металл покрытия (цинк) становится анодом и разрушается вместо основного металла (железо0.Н2
е−
Fe
Zn2+
Zn
H2O
A
K
Схема коррозии.
(+)К [Fe]: 2H+ + 2e- H20
(при рН 7) или
О2 + 2Н2О + 4е- 4ОН-
(при рН = 7 ).
(−)А[Zn]: Zn0 – 2e- Zn2+
Zn2+ + 2OH- Zn(OH)2.
Таким образом, анодное покрытие будет защищать основной металл и при нарушении его целостности.
Слайд 25 Протекторная защита ехр., трубопровода во влажном грунте. К
трубопроводу присоединен цинк, образуется гальванический элемент, в к-ром протектор-цинк,
как более активный металл, будет посылать свои ионы во влажную почву, а по проводнику будут двигаться электроны к защищаемому объекту, т.е. протектор является анодом, а трубопровод – катодом.В качестве протектора для защиты стальных конструкций применяют чистый цинк или сплавы алюминия с цинком, а также сплавы на основе магния.
А [Zn]: Zn0 – 2e- Zn2+
Zn2+ + 2OH- Zn(OH)2
К [Fe]: 2Н+ + 2е- Н2 ( рН 7 )
2H2O + O2 + 4e- ( pH 7 )
Слайд 26 Защита внешним током или катодная защита – защита
металла от коррозии с помощью постоянного тока от внешнего
источника. Защищаемый объект (трубопровод) присоединяется к отрицательному полюсу источника тока (катодно), а к положительному, аноду - железный лом (или старый рельс), который разрушается, сохраняя тем самым трубопровод .Катодную защиту применяют для защиты от коррозии подземных металлических сооружений: нефте-, газо-, водопроводов и др.
Анод (старый рельс):
Fe0 – 2e- Fe2+
Fe2+ + 2OH- Fe(OH)2.
Катод (трубопровод):
2H2O + O2 + 4e- 4OH-.





























![Согласные звуки [б], [б’], буквы Б, б](/img/tmb/13/1206915/7e8335a7d65c29f66fd521fec5d176a4-210x.jpg)