- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Коррозия металлов и защита электрооборудования от нее.
Содержание
- 2. Основы теории коррозииКоррозия – процесс разрушения металлов
- 3. Основы теории коррозииИнтенсивность развития процесса зависит от
- 4. Основы теории коррозии. Классификация процессовКоррозионные процессы классифицируют:по
- 5. Классификация процессов по условиям разрушения
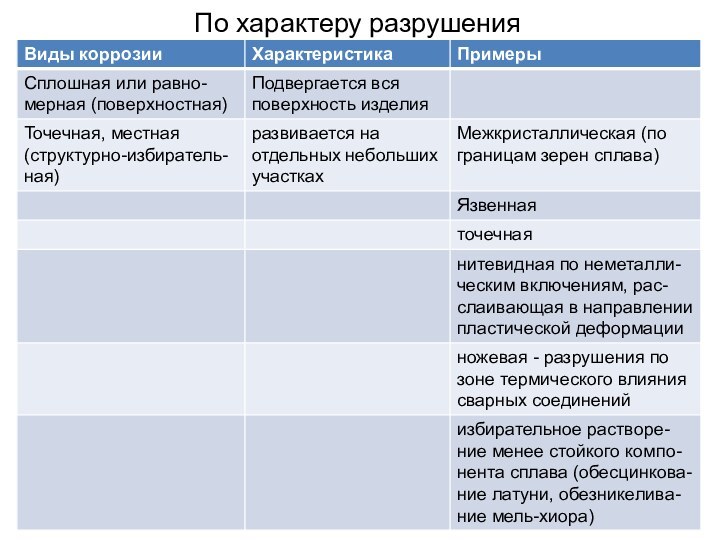
- 6. По характеру разрушения
- 7. Основы теории коррозииНаибольшую опасность представляют структурно-избирательные разрушения.
- 8. Основы теории коррозииКоррозионному растрескиванию подвержены элементы энергетического
- 9. Виды коррозии металлов. Электрохимическая коррозия Электрохимическая коррозия
- 10. Виды коррозии металлов. Электрохимическая коррозия Электрохимическую коррозию
- 11. Виды коррозии металлов. Электрохимическая коррозия Таким образом,
- 12. Виды коррозии металлов. Химическая коррозия Химическая коррозия
- 13. Виды коррозии металлов. Химическая кислородная коррозия Разновидностью
- 14. Виды коррозии металловПленка затрудняет перемещение ионов металла
- 15. Виды коррозии металлов. Химическая подшламовая коррозияПод слоем
- 16. Виды коррозии металлов. Химическая сернистая коррозияПри сжигании
- 17. Виды коррозии металлов. Атмосферная коррозияОколо 80 %
- 18. Виды коррозии металлов. Подземная коррозияПочва и грунт
- 19. Виды коррозии металлов. Подземная коррозияЭлектрическая или электрокоррозия
- 20. Виды коррозии металлов. Стояночная коррозияТакже к электрохимическому
- 21. Виды коррозии металлов. ЭрозияЭрозия - коррозия поверхностного
- 22. Защита металлов от коррозииКоррозионная стойкость - способность
- 23. Методы защиты металлов от коррозии1. Защитные поверхностные
- 24. Методы защиты металлов от коррозии. Защитные металлические
- 25. Методы защиты металлов от коррозии. Защитные покрытияНапример,
- 26. Методы защиты металлов от коррозии. Диффузионные защитные
- 27. Методы защиты металлов от коррозии. Напыляемые защитные
- 28. Методы защиты металлов от коррозии. Неметаллические покрытияСтеклоэмалями
- 29. Методы защиты металлов от коррозии. Неметаллические покрытияСтальные
- 30. Методы защиты металлов от коррозии. Неметаллические покрытияВ
- 31. Методы защиты металлов от коррозииНанесение слоев из
- 32. Методы защиты металлов от коррозии. Анодная защитаДля
- 33. Методы защиты металлов от коррозии. Ингибиторная защитаИнгибиторы
- 34. Методы защиты металлов от коррозии. Антикоррозионная защитаСоздание
- 35. Скачать презентацию
- 36. Похожие презентации
Основы теории коррозииКоррозия – процесс разрушения металлов и сплавов в результате химического или электрохимического воздействия на их поверхность внешней агрессивной средой. Она, как правило, сопровождается образованием на поверхности металла продуктов его разрушения. У сплавов железа в


































Слайд 3
Основы теории коррозии
Интенсивность развития процесса зависит от свойств
самого металла, а также от природы окружающей среды. Большинство
металлов, будучи стойкими в одних средах, довольно легко разрушается при взаимодействии с другими.
Слайд 4
Основы теории коррозии. Классификация процессов
Коррозионные процессы классифицируют:
по условиям
разрушения;
по видам разрушения.
Условия отражают состав агрессивной среды и особенности
работы конструкции.
Слайд 7
Основы теории коррозии
Наибольшую опасность представляют структурно-избирательные разрушения. Им
подвержены металлические сплавы, содержащие фазы с различными термодинамическими свойствами.
Межкристаллитная
коррозия (МКК) один из наиболее опасных и распространенных видов местной коррозии. МКК проникает вглубь металла по границам зерен, снижает металлическую связь между зернами, приводит к резкому падению прочности и пластичности материала. В коррозионно-стойких сталях она связана с обеднением приграничных областей зерен элементом, в частности хромом, обеспечивающим коррозионную стойкость.
Слайд 8
Основы теории коррозии
Коррозионному растрескиванию подвержены элементы энергетического и
нефтехимического оборудования, работающие под давлением. Напряжения могут создаваться также
и в процессе изготовления конструкции. Коррозионной средой является пар в энергетических установках, водные растворы хлоридов и нитратов металлов, щелочей и др. Среда усиливает развитие трещины в результате анодного растворения стали в устье трещины. Между разрушающим напряжением и временем до разрушения при коррозионном растрескивании существует определенная связь. Имеется некоторое критическое напряжение, называемое пределом длительной коррозионной стойкости, ниже которого разрушений металла не происходит. Аустенитные стали плохо сопротивляются коррозионному растрескиванию, ферритные стали же наоборот являются наиболее стойкими к коррозионному растрескиванию.
Слайд 9
Виды коррозии металлов. Электрохимическая коррозия
Электрохимическая коррозия –
процесс разрушения на границе раздела поверхностей контакта двух разнородных
металлов в растворах электролитов, в том числе и воде. При этом создается гальванический элемент. Однофазные сплавы в данном случае являются более стойкими.Этот тип коррозии характеризуется протеканием электрического тока, переходом атомов в ионизированное состояние (анодный), восстановления окислителя (катодный) и другими электрохимическими процессами (перенос электронов от одного участка поверхности к другому). Их скорость зависит от электродного потенциала, она определяется законами электрохимической кинетики и может быть выражена в электрических единицах (например, А/м2·ч).
Слайд 10
Виды коррозии металлов. Электрохимическая коррозия
Электрохимическую коррозию вызывают
загрязнения и примеси, находящиеся в металле, а также неоднородность
его поверхности. В этих случаях при соприкосновении металла с электролитом, в частности с водой, на его поверхности возникает множество микрогальванических элементов. При этом анодами будут частички металла, а катодами – загрязнения и примеси. Аноды растворяются, на катодах происходит связывание электронов. Совершенно чистые металлы разрушению практически не подвергаются.На скорость электрохимической коррозии влияют внутренние и внешние факторы. Внутренними причинами являются состав, структура и состояние поверхности металла и напряжения. Повышение чистоты обработки увеличивает коррозионную стойкость. К внешним факторам относятся: температура, давление, скорость движения сред и др.
Слайд 11
Виды коррозии металлов. Электрохимическая коррозия
Таким образом, при
электрохимической коррозии поток электронов направлен от более активного металла
к менее возбужденному (проводнику), и первый корродирует. Скорость коррозии тем выше, чем дальше расположены друг от друга в ряду напряжений металлы, из которых сформировалась гальваническая пара. На нее также влияет и характер раствора электролита, т. е. его кислотность (рН – водородный показатель среды). Чем он ниже (лежит в интервале 0 - 7), тем больше содержание окислителей в растворе и тем скорее протекает коррозия. Значительно быстрее проходит процесс разрушения и с повышением температуры.
Слайд 12
Виды коррозии металлов. Химическая коррозия
Химическая коррозия –
следствие чисто химических реакций металла с окружающей средой. При
этом процессы окисления и восстановления протекают в одном акте. Скорость данного вида разрушения определяется кинетикой химических реакций.Химическая коррозия обуславливается взаимодействием металла с сухими газами или жидкостями, не проводящими электрического тока. Наибольший вред приносят разрушения под действием газов. Газовая коррозия наружной поверхности труб и стоек пароперегревателей происходит под воздействием кислорода, двуокиси углерода, водяных паров, сернистого и других газов.
Слайд 13
Виды коррозии металлов. Химическая кислородная коррозия
Разновидностью газовой
коррозии является кислородная коррозия, которая заключается во взаимодействии металлов
и сплавов с кислородом, т. е. в переходе его в наиболее термодинамически устойчивое состояние за счет того, что окислитель отнимает у него валентные электроны, переводя в связанное состояние - оксид, образующий на поверхности металла пленку. От состава, структуры и свойств этих пленок зависит скорость химической коррозии. Защитные свойства данных слоев в значительной степени определяются их плотностью и сплошностью. (Условие сплошности: молекулярный объем соединения, возникающего из металла и окислителя Vок, должен быть больше объема металла VМе, пошедшего на образование молекулы вещества. Хорошие защитные свойства имеют пленки с отношением Vок/VМе = 1,0 - 2,5).
Слайд 14
Виды коррозии металлов
Пленка затрудняет перемещение ионов металла и
окис-лителя друг к другу. Поэтому по мере утолщения пленки
рост ее идет с самоторможением. Процесс состоит из нес-кольких последовательных стадий: адсорбция кислорода, его ионизация, диффузия ионов металла с его восстанов-лением и кислорода через пленку и реакция образования оксида. С увеличением размеров пленки возникающие внутренние напряжения могут приводить к образованию трещин и их скалыванию, и окисление опять будет проис-ходить с начальных стадий. При высоких температурах скорость окислительного разрушения многих металлов сильно возрастает. У некоторых металлов образующиеся в процессе химической коррозии слои оксидов являются защитными. Это обусловлено их химической неактив-ностью (пассивностью). Поэтому дальнейшее соприкосно-вение его с кислородом сильно замедляет процесс корро-зии. Такая пленка всегда имеется на поверхности алюминия, хрома, ни-келя, титана, вольфрама, молибдена и еще некоторых металлов. Также, концентрированные азотная и серная кислоты легко делают железо пас-сивным, создавая на его поверхности защитную пленку и оно далее не реагирует с этими кислотами, т. е. не разрушается.
Слайд 15
Виды коррозии металлов. Химическая подшламовая коррозия
Под слоем отложений
на внутренней поверхности труб в кон-такте с котловой водой
развивается подшламовая коррозия, имеющая язвенный характер и приводящая к образованию свищей. Язвы заполняются продуктами коррозии и трудно об-наруживаются При рН меньше 7,0 скорость коррозии опреде-ляется процессами восстановления ионов водорода, форми-рующихся при диссоциации котловой воды, на катодных участ-ках и растворения получающегося водорода в металле. Проис-ходит интенсивное разрушение и насыщение металла водоро-дом. Растворенный в стали атомарный водород вызывает сни-жение прочности и пластичности. При высоких температурах он уменьшает длительную прочность и ускоряет ползучесть. Это явление называется водородной хрупкостью (охрупчива-ние). При рН больше 7,0 образование ионов водорода сильно подавлено. Выделившийся водород становится частью потока пароводяной смеси. Имеет место коррозионное поражение без водородного охрупчивания.
Слайд 16
Виды коррозии металлов. Химическая сернистая коррозия
При сжигании топлив
с большим содержанием серы поверхности нагрева, стальные короба газоходов
и дымовые трубы подвергаются низкотемпературной сернистой коррозии, которая заключается в следующем.Сгорание мазута и углей, окисление серосодержащих органических соединений происходит с образованием диоксида SO2 по реакции:
2H2S + 3О2 = 2SO2 + 2Н2О
При температуре 400 – 1400 С небольшая часть SO2 окисляется до триоксида SO3.
Водяные пары и SO3 перемещаются по газовому тракту котла и охлаждаются. При определенной температуре, называемой точкой росы кислотных паров, начинается выпадение серной (H2SO4) кислоты, которая конденсируется и оседает на поверхностях нагрева. При взаимодействии ее с металлом образуются сульфаты железа Fe2(SO4)3 и FeSO4.
Слайд 17
Виды коррозии металлов. Атмосферная коррозия
Около 80 % металлических
конструкций эксплуатируется на открытом воздухе. Сухая атмосферная коррозия происходит
по механизму химического окисления и роста пленки. Мокрое атмосферное разрушение является электрохимическим процессом. Скорость его возрастает с ростом относительной влажности. Наиболее агрессивны сильно загрязненные индустриальные и приморские среды, наименее - чистые и сухие континентальные атмосферы.
Слайд 18
Виды коррозии металлов. Подземная коррозия
Почва и грунт содержат
различные химические реагенты, в том числе и влагу, и
обладают ионной проводимостью. Подземная коррозия происходит по электрохимическому процессу. Ее подразделяют на грунтовую и блуждающими токами (электрическую). Грунтовая коррозия зависит от влажности, электропроводности (количества солей), кислотности грунта (рН находится в пределах 3 - 9) и от деятельности микроорганизмов, которые могут ускорить процесс разрушения в 20 раз. Наиболее опасны анаэробные сульфатредуцирующие бактерии. Они восстанавливают содержащиеся в грунте сульфаты по схеме:MgSO4 + 4Н Mg(OH)2 + H2S +О2
Кислород ускоряет ход катодного процесса коррозии.
Слайд 19
Виды коррозии металлов. Подземная коррозия
Электрическая или электрокоррозия вызывается
блуждающими токами (токи утечки), исходящими от трамваев, метро, электрических
железных дорог и различных электроустановок, работающих на постоянном токе. Они разрушают подземные металлические сооружения, трубопроводы и электрокабели. Различного рода токи утечки, проходя в грунте и встречая металлическую поверхность, проникают в нее и вызывают появление участков входа и выхода тока. Это приводит к образованию на металле катодных и анодных зон. В месте протекания и выхода тока происходит усиленное анодное растворение металла, а в районе входа - катодное подщелачивание грунта.Блуждающие токи от источников переменного тока вызывают слабую коррозию у подземных изделий из стали и сильную – из цветных металлов и их сплавов.
Слайд 20
Виды коррозии металлов. Стояночная коррозия
Также к электрохимическому типу
относится стояночная коррозия. Это разрушения металлов в воде, содержащей
кислород, протекающее при комнатной температуре после остановки оборудования ТЭЦ.Характерные особенности стояночной коррозии - образование язв на поверхности металла и накопление большого количества продуктов разрушения.
После останова котла на трубах остаются мокрый шлак и зола, в которых интенсивно протекает коррозия. Снаружи труба покрывается толстым слоем бурого гидрооксида железа – Fe(OH)3.
Слайд 21
Виды коррозии металлов. Эрозия
Эрозия - коррозия поверхностного слоя
металла под действием ударяющихся в него твердых частиц, капелек
или потока жидкости, а также потока пара.Это сложный в химическом отношении процесс. В основном он заключается в разрушении оксидной пленки металла.
Коррозия поверхностного слоя металла под влиянием многократных гидроударов называется кавитационной эрозией. Кавитация - это процесс образования и быстрого исчезновения пузырьков паров жидкости вследствие локального изменения давления в ее потоке.
При исчезновении пузырька поверхность металла испытывает локальный гидравлический удар. Эрозия развивается в результате разрушения менее прочных структурных составляющих (например, феррита в перлитных сталях).
Слайд 22
Защита металлов от коррозии
Коррозионная стойкость - способность материала
сопро-тивляться воздействию агрессивной среды. Она может оп-ределяться качественно и
количественно: изменением массы образцов, показателей их физических и механичес-ких свойств, уменьшением толщины образцов, объема вы-делившегося водорода (или поглощенного кислорода) и др.Коррозия причиняет огромные убытки. В результате нее металлические изделия теряют свои ценные технические свойства. Поэтому имеют очень большое значение меры борьбы с коррозией.
Слайд 23
Методы защиты металлов от коррозии
1. Защитные поверхностные покрытия
металлов. Они бывают металлические и неметаллические. Металлические покрытия в
свою очередь подразделяют на: гальванические; полученные, погружением в расплав; плакированием металлов; диффузионные и изотермически напыленные. Неметаллические покрытия бывают: силикатные (эмалированные); фосфатные; керамические, полимерные, лакокрасочные и порошкообразные.2. Электрохимическая защита: катодная и анодная.
3. Химический способ - применение ингибиторов коррозии.
4. Обескислороживание воды.
5. Создание сплавов с антикоррозионными свойствами.
Слайд 24 Методы защиты металлов от коррозии. Защитные металлические гальванические
покрытия
Такие покрытия изолируют металл от внешней среды. Их на-носят
электролитическим способом, подбирая состав элект-ролита, плотность тока и температуру среды. Метод позволяет получать очень тонкие надежные слои металлов (цинк, ни-кель, хром, свинец, олово, медь, кадмий) и является эконо-мичным. Покрытие железных изделий этими и другими метал-лами помимо защиты, придает им красивый внешний вид.Тщательная очистка покрываемого изделия от загрязнений - одно из важных условий получения качественного покрытия. К загрязнениям относятся: жиры, масла и оксиды. Обработку покрываемой поверхности производят тремя способами: ме-ханическим (шлифовка, песко- и дробеструйная очистка), хи-мическим и электрохимическим (обезжиривание, травление и электрохимическое полирование). Хранение подготовленных изделий до покрытия не более 4 - 6 часов.
Слайд 25
Методы защиты металлов от коррозии. Защитные покрытия
Например, кровельное
железо предохраняют от коррозии цинком. Цинк, хотя и является
более активным металлом, чем железо, покрыт снаружи защитной окисной пленкой. При ее повреждении возникает гальваническая пара железо-цинк. Катодом (положительным) служит железо, анодом (отрицательным) - цинк. Электроны переходят от цинка к железу, цинк растворяется, но железо остается защищенным до тех пор, пока слой цинка не разрушится до конца.Методом погружения деталей в расплав наносятся например, покрытия из цинка и олова. Защитный слой ( = 10 - 50 мкм) имеет диффузионное сцепление с основой. Недостатки метода - трудность достижения равномерной толщины покрытия, а также большой расход металла, который например, при использовании цинка для слоя толщиной 25 мкм составляет до 600 г/м2.
Слайд 26 Методы защиты металлов от коррозии. Диффузионные защитные покрытия,
плакирование
Диффузионный способ защиты основан на изменении хими-ческого и фазового
состава поверхностного слоя металла при вхождении в него подходящих элементов, которые обес-печивают коррозионную стойкость. Стали от атмосферной коррозии сохраняют цинкованием, алитирование применяют для защиты от окисления при повышенных температурах. Кремниевые покрытия (силицирование) используют для пре-дохранения жаростойких металлов, борирование – для повы-шения износостойкости и прочности.Плакирование металлов используют для изготовления биме-таллических листов типа сталь-никель, сталь-титан, сталь-медь, сталь-алюминий. Его проводят методами совместного горячего пластического деформирования, электродуговой и электрошлаковой наплавкой, сваркой взрывом.
Слайд 27
Методы защиты металлов от коррозии. Напыляемые защитные покрытия
Напыляемые
покрытия получают газотермическим, плазменным, детонационным и вакуумным способами. При
этом металл распыляется в жидкой фазе в виде капель и осаждается на покрываемую поверхность. Метод прост, позволяет получать слои любой толщины с хорошим сцеплением с основным металлом. При вакуумном способе материал покрытия нагревают до состояния пара, и паровой поток конденсируется на поверхности изделия. Методы напыления позволяют защищать сборные конструкции. Однако расход металла при этом очень значительный, а покрытие получается пористым и для обеспечения противокоррозионной защиты требуется дополнительное уплотнение термопластическими смолами или другими полимерными материалами. При восстановлении изношенных деталей машин пористость является весьма ценной, так как служит носителем смазочных материалов.
Слайд 28
Методы защиты металлов от коррозии. Неметаллические покрытия
Стеклоэмалями называются
стекла, наносимые тонким слоем на поверхность металлических предметов с
целью защиты от коррозии, придания им определенной окраски и улучшения внешнего вида, создания отражающей поверхности и пр.Производство эмалированных изделий включает в себя следующие операции: высокотемпературный синтез-варка эмалевых стекол (фриттов); приготовление из них порошков и суспензий; подготовка поверхности металлических изделий и собственное эмалирование - нанесение суспензии на поверхность металла, сушка и оплавление порошкообразного стекла в покрытие.
Слайд 29
Методы защиты металлов от коррозии. Неметаллические покрытия
Стальные изделия
грунтовой эмалью покрываются обыч-но двух- и трехкратно. Общая толщина
получаемого пок-рытия в среднем равна 1,5 мм. После сушки полученного грунта при температуре 90 – 100 °С деталь далее обжига-ют при 850 – 950 С. С целью увеличения долговечности эмалевых покрытий стальных труб в теплоэнергетике их наносят по слою напыленного алюминия.В основе фосфатирования стальных изделий лежит про-цесс образования нерастворимых в воде двух- и трехза-мещенных фосфатов железа, цинка и марганца. Они об-разуются при погружении изделий в разбавленный раст-вор фосфорной кислоты с добавкой однозамещенных фосфатов вышеперечисленных металлов. Получающийся фосфатный пласт хорошо сцеплен с металлической осно-вой. Эти покрытия пористы, поэтому на них дополнитель-но нужно нанести лак или краску. Толщины фосфатных слоев составляют 10 – 20 мкм.
Слайд 30
Методы защиты металлов от коррозии. Неметаллические покрытия
В качестве
керамической защиты используются покрытия на основе оксидов некоторых р-элементов,
также кремни-земистые, алюмисиликатные, магнезильные, карборундо-вые и другие. Получили развитие новые материалы, назы-ваемые керметами. Это металлокерамические смеси или комбинации металлов с керамикой, например Al - Al2O3 (САП), V – Al - Al2O3 (твэл). Они находят применение в ре-акторостроении. По сравнению с простой керамикой кер-меты обладают большей прочностью и пластичностью, имеют очень высокую сопротивляемость механическим и тепловым ударам.Лакокрасочные покрытия наносят распылением возду-хом, высоким давлением и в электрическом поле; элект-роосаждением, струйным обливом, окунанием, валиками, кистью и т.д. Искусственная сушка красок может выпол-няться горячим воздухом, в камерах, инфракрасным и ультрафиолетовым излучениями.
Слайд 31
Методы защиты металлов от коррозии
Нанесение слоев из порошков
полимеров осуществляют газопламенным, вихревым и электростатическим напылением. При температуре
650 –700 С порошкообразный полимер размягчается и при ударе о подготовленную и нагретую до температуры давления полимера поверхность детали сцепляется с ней, образуя сплошное покрытие. Для напыления успешно используют полиэтилен, поливинилхлорид, фторопласты, нейлон и другие полимерные материалы.
Слайд 32
Методы защиты металлов от коррозии. Анодная защита
Для катодной
защиты стали в почве и нейтральных водных растворах минимальный
потенциал составляет 770 – 780 мВ. Предусматривается одновременная пленоч-ная изоляция поверхности изделия от контакта с коррози-онной средой.Анодную защиту применяют только для оборудования из сплавов, склонных к пассивации в данном технологичес-ком растворе. Коррозия этих сплавов в инертном состоя-нии протекает гораздо медленнее. Используется источник постоянного тока с автоматическим регулятором потенциала анодной поляризации защищаемого металла.
В зависимости от агрессивности среды при анодно-про-текторной защите применяют катоды из кремнистого чугу-на, молибдена, сплавов титана и нержавеющих сталей. Так предохраняют теплообменники из нержавеющих ста-лей, работающие в 70 – 90 %-ной серной кислоте при тем-пературе 100 –120 С.
Слайд 33
Методы защиты металлов от коррозии. Ингибиторная защита
Ингибиторы коррозии
- это вещества, замедляющие ско-рость разрушения металлических изделий. Даже
в малом количестве они заметно снижают скорость обоих меха-низмов коррозии. Их вводят в рабочую агрессивную среду или наносят на детали. Они адсорбируются на металли-ческой поверхности, взаимодействуют с ней с образовани-ем защитных пленок и тем самым препятствуют протека-нию разрушительных процессов. Некоторые антиоксидан-ты способствуют удалению кислорода (или другого окис-лителя) из рабочей зоны, что также снижает скорость кор-розии.Ингибиторы - многие неорганические и органические сое-динения и разнообразные смеси на их основе. Их широко применяют при химической очистке паровых котлов от на-кипи, снятии окалины методом кислотной промывки, а так-же при хранении и перевозке неорганических сильных кислот в стальной таре и других.





























