- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Кулонометрия
Содержание
- 2. Жоспар:1. Кулонометриялық әдістердің жіктелуі.2. Тікелей кулонометрия3. Электролиз4. Кулонометрлік титрлеу
- 3. Кулонометрия Кулонометриялық әдіс
- 4. Кулонометрлік талдау жүргізгенде мына шарттар
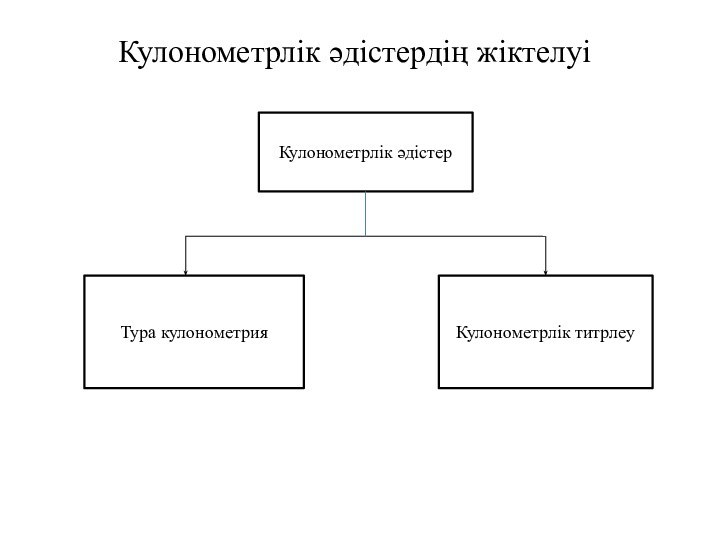
- 5. Кулонометрлік әдістердің жіктелуіКулонометрлік әдістерТура кулонометрияКулонометрлік титрлеу
- 6. Тура кулонометрия Тура кулонометрия
- 7. Электогравиметрия Электрогравиметрия әдісі электродта электролит құрамынан
- 8. Электрогравиметриялық құрылғыЭлектролиз жүретін аспаптың схемасы.1 – аккумулятор;
- 9. Электролиз Электролиз
- 10. Электролиз
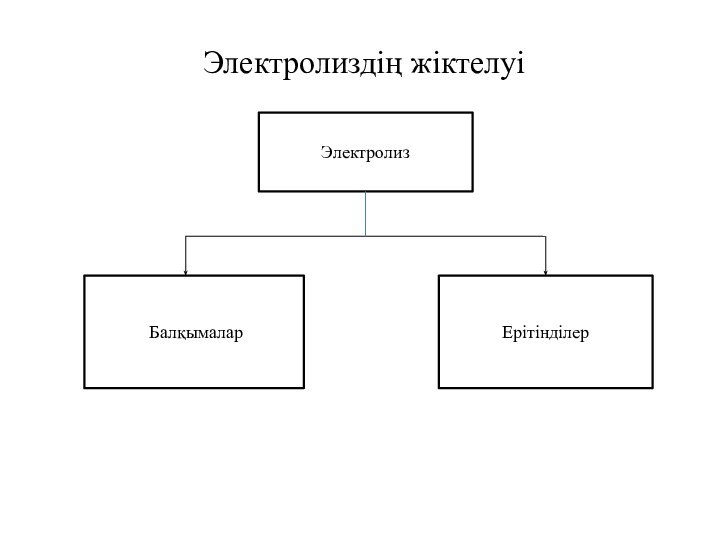
- 11. Электролиздің жіктелуіЭлектролиз БалқымаларЕрітінділер
- 12. Тұздардың балқымасының электролизі 1. Металл тұзы және
- 13. Кадмий хлориді балқымасының электролизі
- 14. Натрий сульфаты ерітіндісінің электролизі
- 15. Электролит ерітінділері электролизі Катодтық процесс
- 16. Анодтық процесс
- 17. Фарадей
- 18. Ішкі электролизге арналған құрылғыІшкі электролизге арналған құрылғы: 1) анод; 2) катод; 3) ұстағыш; 4) стакан.
- 19. Кулонометрлік титрлеу әдісіТұрақты ток кезіндегі кулонометрлік титрлеу
- 20. Кулонометрлік титрлеу әдісі Кулонометрлік титрлеу қондырғысының
- 21. Калий
- 22. Скачать презентацию
- 23. Похожие презентации


















Слайд 2
Жоспар:
1. Кулонометриялық әдістердің жіктелуі.
2. Тікелей кулонометрия
3. Электролиз
4. Кулонометрлік
титрлеу
Слайд 3
Кулонометрия
Кулонометриялық әдіс ерітінді
мен балқымадағы электрохимиялық реакция толық жүруі үшін қажетті электрдің
мөлшерін өлшеуге негізделген.Red – nē Ox
Бұл әдіспен талдаған кезде тіпті аз концентрацияның өзі анықталынады, талдауды оңай автоматтандыруға болады. Кулонометрлік талдаудың реагенті – электр тогы.
Слайд 4 Кулонометрлік талдау жүргізгенде мына шарттар орындалуы
қажет:
1) Ток бойынша шығымы 100% - ға тең болатын
тек бір ғана электрохимиялық реакцияның жүруі керек.2) Тура кулонометриядағы электрохимиялық түрлену құбылысының соңын немесе кулонометрлік титрлеу кезіндегі табудың тәсілі болу керек.
3) Электрохимиялық әрекеттескен заттың массасын есептеу үшін реакцияға жұмсалынатын электр мөлшері дәл де, сенімді анықталуы керек.
Слайд 5
Кулонометрлік әдістердің жіктелуі
Кулонометрлік
әдістер
Тура кулонометрия
Кулонометрлік титрлеу
Слайд 6
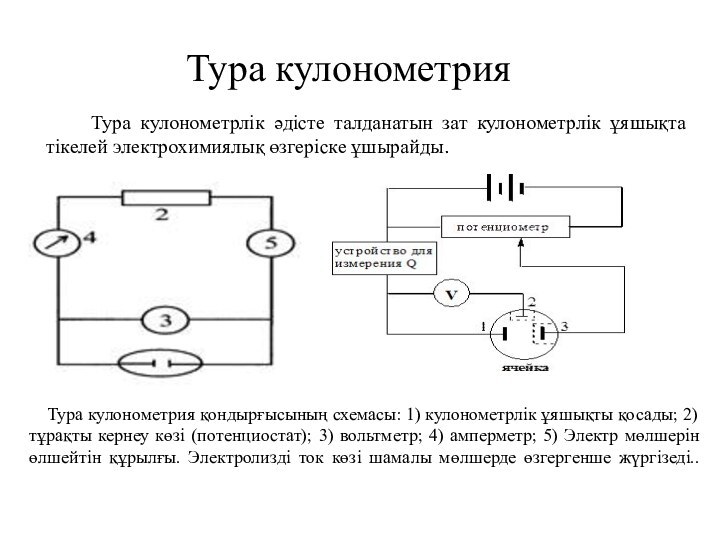
Тура кулонометрия
Тура кулонометрия қондырғысының схемасы: 1)
кулонометрлік ұяшықты қосады; 2) тұрақты кернеу көзі (потенциостат); 3)
вольтметр; 4) амперметр; 5) Электр мөлшерін өлшейтін құрылғы. Электролизді ток көзі шамалы мөлшерде өзгергенше жүргізеді.. Тура кулонометрлік әдісте талданатын зат кулонометрлік ұяшықта тікелей электрохимиялық өзгеріске ұшырайды.
Слайд 7
Электогравиметрия
Электрогравиметрия әдісі электродта электролит құрамынан металл
күйінде электрохимиялық шөгінді бөлінуіне, бөлінген шөгіндіні массасы бойынша есептеп,
анықтауға негізделген. Бұл әдіс металды аналитикалық анықтауда қолданылады: катодта металл жеке түрде электртотықсыздану процесі нәтижесінде, анодта қышқыл электртотығу процесі нәтижесінде бөлінуі мүмкін.
Слайд 8
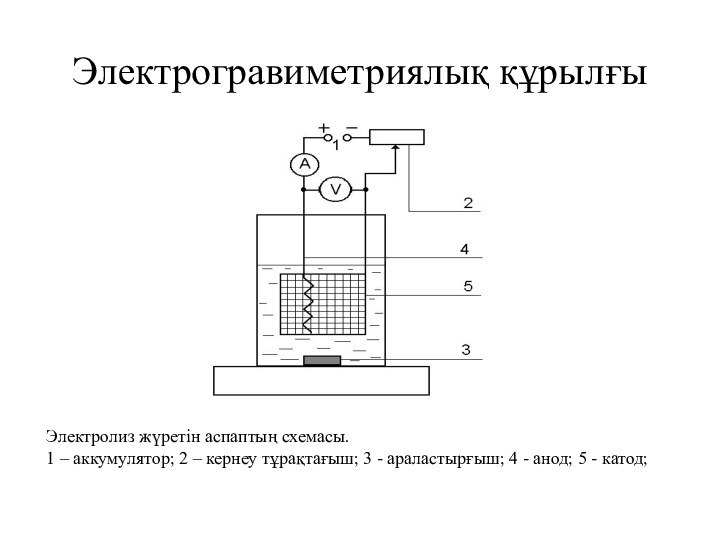
Электрогравиметриялық құрылғы
Электролиз жүретін аспаптың схемасы.
1 – аккумулятор; 2
– кернеу тұрақтағыш; 3 - араластырғыш; 4 - анод;
5 - катод;
Слайд 9
Электролиз
Электролиз –
электролиттің балқымасы мен ерітіндісі арқылы электр тогы өткенде электродта
жүретін тотығу – тотықсыздану процесі. Катодта( теріс зарядталған бөлшек) тотықсыздану процесі жүреді:Fe3+ + e- = Fe2+
Cu2+ + 2e- = Cu0
Анодта(оң зарядталған бөлшек) тотығу процесі жүреді:
2Сl- - 2e- = Cl2
Слайд 12
Тұздардың балқымасының электролизі
1. Металл тұзы және оттексіз қышқыл
NaCl ↔ Na+ + Cl-
катод(-): Na+ + 1e = Na0 2анод(+): 2Cl- — 2e = Cl2 1
2NaCl → 2Na + Cl2
2. Металл тұзы және оттекті қышқыл
Na2SO4↔2Na++SO42-
K(-): Na+ +1e =Na0 4
A(+): 2SO42- −4e =2SO3+O2 1
2Na2SO4 → 4Na + 2SO3 + O2
Слайд 13
Кадмий хлориді балқымасының электролизі
CdCl2 → Cd2+ + 2Cl
Cd2++2Сl- → Cd0 + Cl20 Катод(-):
Анод(+):
Cd2+
2Cl-
+ 2ē = Cd0
- 2ē = Cl20
тотықсыздану
тотығу
Слайд 14
Натрий сульфаты ерітіндісінің электролизі
Na2SO4 = 2Na+ + SO42–
K(- ):
Na+ + ē = Na0 ; 0 = 2,71 В
2H2O + 2ē = H2 + 2OH- 0 = -0,828 В
2H2O 4ē = O2 + 4H+ 0 = +1,23 В
А(+):
6H2O = 2H2 + 4OH- + O2 + 4H+
2H2O = 2H2 + O2
Na2SO4 + 2H2O = 2H2 + O2+(Na2SO4)
Слайд 17 Фарадей заңы
— электролиттер арқылы электр тогы өткенде электродтарда бөлінетін не
ыдырайтын заттардың мөлшерін (массасын) анықтайтын электролиз процесінің негізгі заңы. Қайтымды электродтық процестер үшін Фарадей заңы орындалады:Э – эквиваленттің молекулалық массасы, М – мольдік масса, г/моль; I – ток күші, А; t – уақыт, с; n – реакцияға қатысқан электрондар саны; 96500 – Фарадей саны (не Фарадей тұрақтысы) Кл/моль; Q – электр мөлшері, Кл.
Слайд 18
Ішкі электролизге арналған құрылғы
Ішкі электролизге арналған құрылғы: 1)
анод; 2) катод; 3) ұстағыш; 4) стакан.
Слайд 19
Кулонометрлік титрлеу әдісі
Тұрақты ток кезіндегі кулонометрлік титрлеу сызбасы:
1 — титрлеуге арналған ыдыс; 2,3 — электродтар; 4
— шыны тұтқа; 5 — тұрақты ток бергіш; 6 — кілт; 7 — амперметр; 8 — араластырғыш; 9 — электрлік сағат.
Слайд 20
Кулонометрлік титрлеу әдісі
Кулонометрлік титрлеу қондырғысының схемасы.
1) Кулонометрлік ұяшықты қосады; 2) тұрақты ток көзі(гальваностат); 3)
амперметр; 4) электрохронометр или секундометр. Кулонометрлік титрлеу әдісінде анықталатын зат әдейі таңдалынып алынған ерітінді – электролит электролизі кезінде кулонометрлік ұяшықта түзіліп, титрантпен әрекеттеседі. Бұл әдісте тұрақты ток көзі қолданылады.
Слайд 21 Калий хлориді
ерітіндісінің платиналық электродта катодтық және анодтық кеңістіктермен бөлінген ұяшықтағы
электролизін қарастырайық. Мұндай ерітінділердің электролизі кезінде электродтардың потенциалы электролиттің құрамдас бөліктерінің ыдырау потенциалының мәніне дейін ығысады, яғни электрлік белсенді зат – судың ыдырау потенциалына дейін ығысады. Калий мен хлордың иондары электродтық құбылысқа қатыспайды, өйткені ол үшін олардың өздеріне сәйкес жоғары мәндегідей потенциал қажет. Демек,анодта 2H2O - 4ē O2 + 4H+
катодта 2H2O - 2ē H2 + 2OH-
жүреді.





























