Слайд 2
ЛЕКЦИЯ № 1
ФЕРМЕНТЫ:
основные понятия, регуляция активности
Слайд 3
Актуальность темы
Изучение ферментов способствует познанию феномена жизни
Биохимические реакции
– основа физиологических процессов
Ферменты – «возбудители всех химических превращений
у живых существ» (И.П. Павлов)
Изучение ферментов необходимо для понимания связи между ферментами и наследственными болезнями обмена веществ
Изучение ферментов позволяет расширять область их использования в медицине
Успехи биохимии, молекулярной биологии и медицины связаны с развитием энзимологии
Слайд 4
История энзимологии
Пищеварение — это идущие внутри тела химические
реакции, важнейшую роль в которых играет химический реагент –
«фермент» (от лат. fermentum «брожение»)
Ян Баптист Ван Гельмонт (17 в):
Лат. fermentum, греч. enzym
Слайд 5
Артур Корнберг (1918 – 2007)
Кэри Мюллис (р. 1944)
Открытие
ДНК-полимеразы (1956)
Открытие механизма биосинтеза НК (Нобелевская премия 1959 совместно
с Северо Очоа)
Создание высокоэффективного метода ПЦР-диагностики (1983)
Нобелевская премия совместно с Майклом Смитом (1993)
Слайд 6
План лекции
Понятие о ферментах и особенности ферментативного катализа
(свойства ферментов)
Структура и механизм действия ферментов
Сложные ферменты и
их кофакторы Мультиферментные комплексы
Кинетика ферментативных реакций
Регуляция активности ферментов
Слайд 7
Цель
Знать:
строение, свойства и роль ферментов в организме
человека
химико-биологическую сущность ферментативного катализа, условия протекания ферментативных реакций
механизмы регуляции
активности ферментов для понимания биохимических основ функционирования организма
Уметь:
использовать знания о ферментативном катализе для понимания принципов методов определения активности ферментов в клинической лабораторной диагностике с целью выявления патологических процессов в органах и системах детей и подростков
Слайд 8
Понятие о ферментах
Ферменты – белковые катализаторы химических
реакций в живом организме
состоят из L-α-аминокислот, соединенных пептидными связями
имеют
4 уровня организации молекул
характерна конформационная лабильность
при денатурации теряют активность
синтезируются как белковые молекулы
И.П. Павлов: переваривающая способность желудочного сока зависит от количества белка в нем (отсюда следует, что пепсин – белок)
Слайд 9
Особенности ферментативного катализа: сравнение с неорганическими катализаторами
Сходства
Различия
(свойства ферментов)
Катализируют
реакции возможные по термодинамическим условиям
Снижают энергию активации реакции
Не изменяют
термодинамических характеристик реакции (не смещают равновесие)
Многие ферменты катализируют прямую и обратную реакции
Не расходуются в процессе реакции
Уникальность структуры
Высокая эффективность катализа
Высокая специфичность действия
Конформационная лабильность
Регулируемая активность
Проявляют активность в оптимальных для организма условиях
Слайд 10
Высокая эффективность ферментативного катализа
2Н2О2 → 2Н2О + О2
самопроизвольно
(Еа = 70 кДж/моль)
при участии железа (Еа = 42
кДж/моль), скорость реакции увеличивается в 103 раз
в присутствии каталазы (Еа = 7 кДж/моль), скорость реакции увеличивается в 1010 раз
Что лежит в основе высокой эффективности ферментативного катализа?
Слайд 11
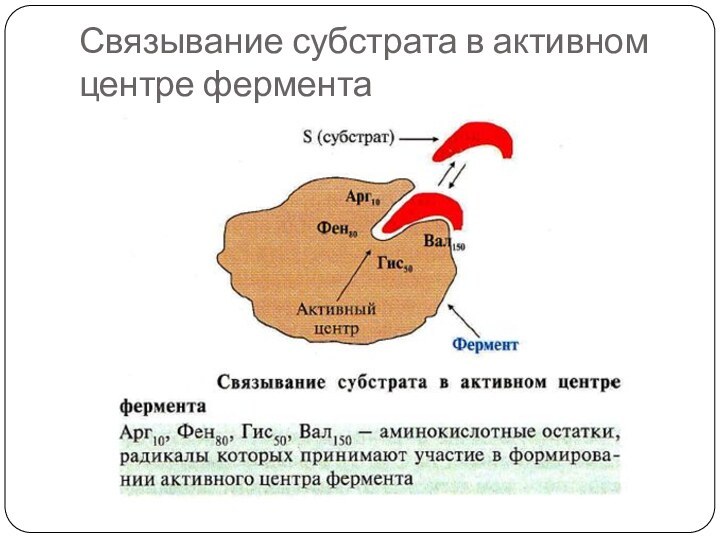
Структура фермента: активный центр
Активный центр фермента (АЦ)
– это участок молекулы фермента, способный комплементарно (специфически) связываться
с субстратом и обеспечивать его каталитическое превращение
Формируется на уровне III структуры белка
У сложных ферментов имеет кофактор (кофермент)
Участок связывания активного центра обеспечивает сродство к субстрату и формирование фермент-субстратного комплекса (ES)
Каталитический участок активного центра осуществляет химическую реакцию
Слайд 12
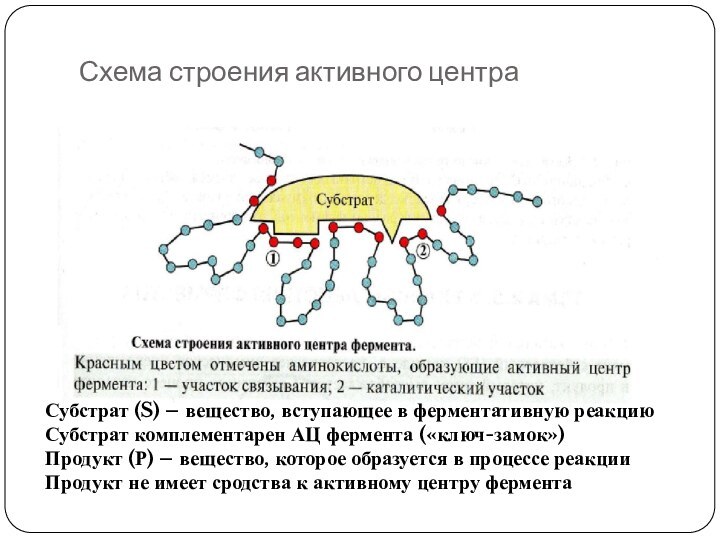
Схема строения активного центра
Субстрат (S) – вещество, вступающее
в ферментативную реакцию
Субстрат комплементарен АЦ фермента («ключ-замок»)
Продукт (Р) –
вещество, которое образуется в процессе реакции
Продукт не имеет сродства к активному центру фермента
Слайд 13
Связывание субстрата в активном центре фермента
Слайд 14
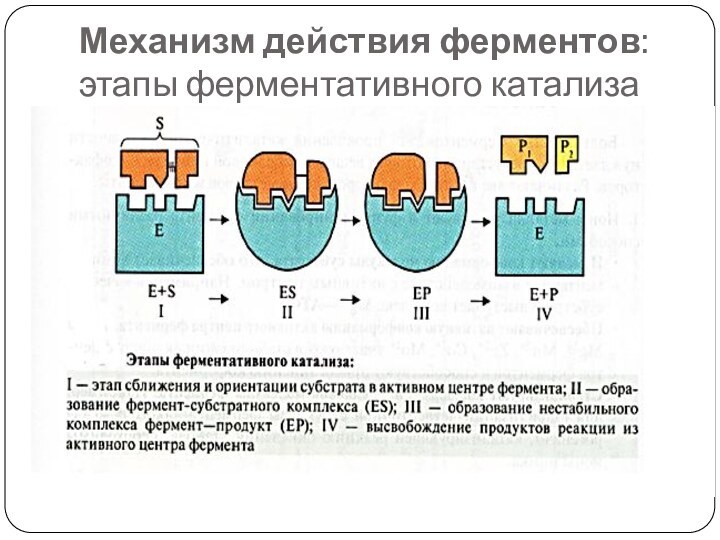
Механизм действия ферментов: этапы ферментативного катализа
Слайд 15
Фермент-субстратный комплекс (ES)
Образование ES – это ключевой момент
ферментативной реакции, основа высокой эффективности катализа
ES образуется в результате
индуцированного соответствия фермента и субстрата
(теория Д. Кошленда, 1958) :
субстрат индуцирует конформационные изменения фермента и его активный центр принимает необходимую для связывания с субстратом пространственную ориентацию
(фермент активен только в присутствии субстрата)
субстрат также претерпевает конформационные перестройки
Слайд 16
Пример индуцированного соответствия
Каталаза – гемопротеин
(сложный фермент: белковая часть
+ гем)
неактивная каталаза: железо в составе гема находится под
плоскостью порфиринового кольца
активная каталаза: при взаимодействии с Н2О2 железо перемещается в плоскость кольца, «настраивая» активный центр фермента
Слайд 17
Итак, высокая каталитическая эффективность ферментов обусловлена
Высокой специфичностью связывания
АЦ фермента и субстрата и образованием ES-комплекса
Конформационной лабильностью ферментов,
которая является основой их высокой специфичности
Слайд 18
Специфичность ферментов
Каталитическая (реакционная) специфичность – способность фермента катализировать
одну химическую реакцию или один тип реакций
Пример: реакции гидролиза,
окисления-восстановления
один и тот же субстрат может подвергаться разным превращениям под влиянием разных ферментов
Исключение: лиазы, в одном направлении, катализируют негидролитическое расщепление субстрата с образованием двойной связи, а в другом – присоединение по кратной связи
Слайд 19
Специфичность ферментов
Субстратная специфичность – способность фермента взаимодействовать с
одним (абсолютная) или несколькими субстратами со сходным строением и
типом связей (относительная, групповая)
абсолютная субстратная специфичность
уреаза: гидролиз мочевины
аргиназа: гидролиз аргинина
относительная субстратная специфичность
пищеварительные ферменты
стереоспецифичность
лактатдегидрогеназа: окисление только L-лактата
Слайд 20
Сложные ферменты
Белок (апофермент) + кофактор (кофермент) → активный
фермент (холофермент)
апофермент – не активен
большинство природных ферментов – сложные
белки-протеиды
простые ферменты: пищеварительные
кофактор – небелковая часть сложного фермента (лат. «вместе делающий»)
Слайд 21
Кофакторы
По химической природе:
неорганические вещества (ионы металлов)
органические вещества (производные
витаминов) - коферменты
По виду химической связи:
слабые взаимодействия (присутствуют в
активом центре фермента только в момент реакции)
ковалентная связь (простетическая группа)
Роль кофактора:
изменение конформации фермента, субстрата
непосредственное участие в реакции (косубстрат)
Слайд 22
Кофакторы – ионы металлов: способы участия в ферментативном
катализе
Изменяют конформацию субстрата (Mg2+-АТФ)
Стабилизируют конформацию апофермента (Zn2+ стабилизирует IV
структуру алкогольдегидрогеназы)
Участвует в катализе (ионы железа, меди участвуют в переносе электронов)
Слайд 23
Cu, Zn-супероксиддисмутаза (СОД)
Zn необходим для стабилизации молекулы
Cu –
активный участник в реакции дисмутации супероксид-аниона:
О2 - + О2 - + 2Н+ = Н2О2 + О2
1) О2 - + Cu2+ + Н+ = Cu1+ + О2
2) О2 - + Cu1+ + Н+ = Cu2+ + Н2О2
Слайд 24
Коферменты, обратимо связанные с апоферментом
NAD+ , NADP+ –
кофермент оксидоредуктаз, источник синтеза – никотиновая кислота (vit РР)
HS-CoA (кофермент А) - кофермент ацилтрансфераз, источник синтеза – пантотеновая кислота (vit B5)
тетрагидрофолат (Н4 –фолат) - кофермент трансфераз - переносчиков С1-фрагментов, источник синтеза – фолиевая кислота (vit B9)
Слайд 25
Простетические группы
флавиновые нуклеотиды FAD, FMN – коферменты оксидоредуктаз,
источник синтеза - рибофлавин (vit В2)
пиридоксальфосфат - кофермент аминотрансфераз,
источник синтеза - пиридоксин (vit В6)
тиаминпирофосфат - кофермент оксидоредуктаз в реакциях окислительного декарбоксилирования кетокислот и кетосахаров, источник синтеза – тиамин (vit В1)
биоцитин - кофермент лигаз, образующих связи С – С, источник синтеза - биотин (vit Н)
Слайд 26
Мультиферментные комплексы
Комплексы ферментов, катализирующие последовательные этапы превращения какого-либо
субстрата
Отличительные особенности комплексов:
прочность ассоциации ферментов
молекулярные массы от 2,3•106 до
10•106
определенный порядок расположения ферментов в соответствии с последовательностью прохождения этапов превращения исходного субстрата
Биологическая значимость комплексов: повышение эффективности процесса превращения
сокращение расстояния, на которые молекулы промежуточных продуктов должны перемещаться при действии изолированных ферментов
Примеры комплексов:
митохондриальная пируватдегидрогеназа и α-кетоглутаратдегидрогеназа
цитоплазматическая синтаза высших жирных кислот
ферментные комплексы дыхательной цепи митохондрий
Слайд 27
Кинетика ферментативного катализа:
условия протекания ферментативных реакций
Активность фермента, или
скорость ферментативной реакции определяется уменьшением количества молекул субстрата или
увеличением количества молекул продукта за единицу времени
активность фермента (1МЕ) = мкмоль (S или P) / мин
уд. активность фермента = мкмоль (S или P) / (мин • мг белка)
Слайд 28
Факторы, определяющие активность фермента (скорость реакции)
Количество фермента
Количество субстрата
Количество
продукта (для аллостерических ферментов)
Концентрация кофактора (для сложных ферментов)
Присутствие активаторов
или ингибиторов
Температура
рН среды
Слайд 29
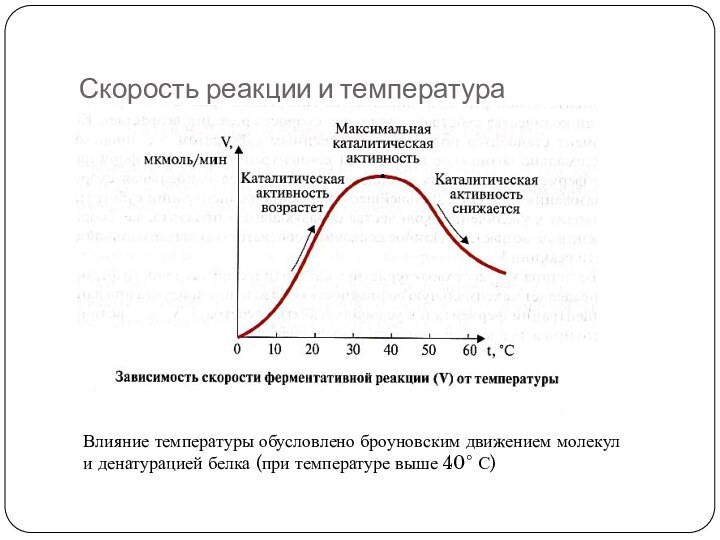
Скорость реакции и температура
Влияние температуры обусловлено броуновским движением
молекул
и денатурацией белка (при температуре выше 40° С)
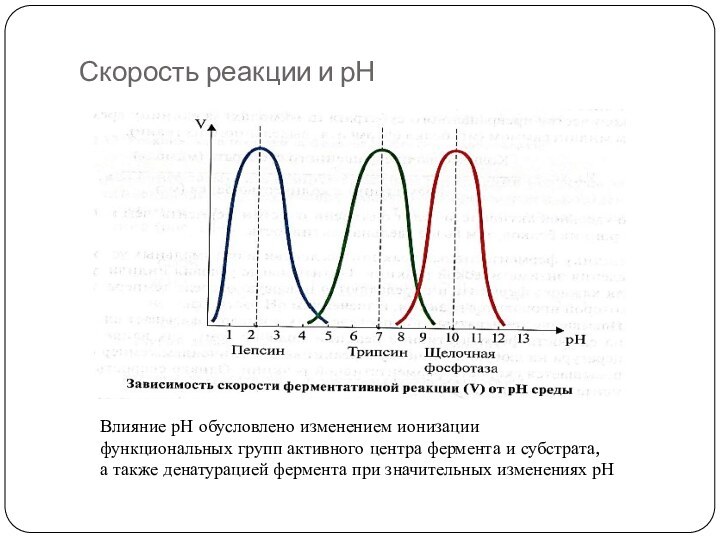
Слайд 30
Скорость реакции и рН
Влияние рН обусловлено изменением ионизации
функциональных
групп активного центра фермента и субстрата,
а также денатурацией фермента
при значительных изменениях рН
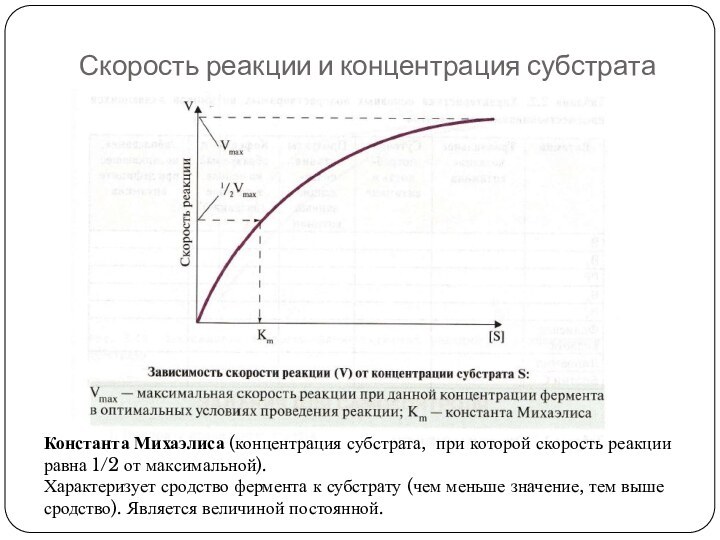
Слайд 31
Скорость реакции и концентрация субстрата
Константа Михаэлиса (концентрация субстрата,
при которой скорость реакции равна 1/2 от максимальной).
Характеризует сродство
фермента к субстрату (чем меньше значение, тем выше сродство). Является величиной постоянной.
Слайд 32
Регуляция активности ферментов – основа регуляции метаболических путей
Способы
регуляции активности ферментов:
Изменение количества фермента
Доступность субстрата и кофермента
Изменение каталитической
активности фермента
Регуляторные ферменты (ключевые) регулируют скорость метаболического пути
Слайд 33
Изменение количества фермента
Регуляция на уровне транскрипции: индукция синтеза
Слайд 34
Доступность молекул субстрата и кофермента
Конститутивные ферменты – синтезируются
постоянно, независимо от наличия субстрата
Индуцибельные (адаптивные) ферменты – синтезируются
только при наличии субстрата
ПРИМЕР: алкогольдегидрогеназа
Слайд 35
Регуляция каталитической активности ферментов
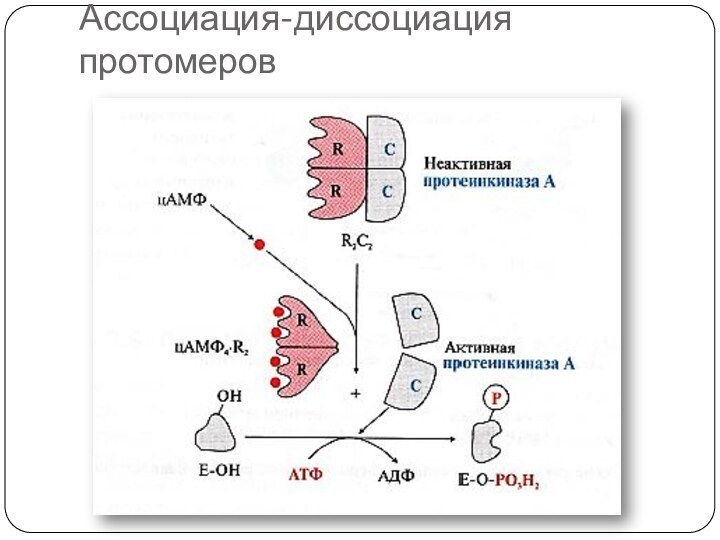
Белок-белковые взаимодействия
присоединение белков-активаторов
ассоциация и диссоциация
протомеров
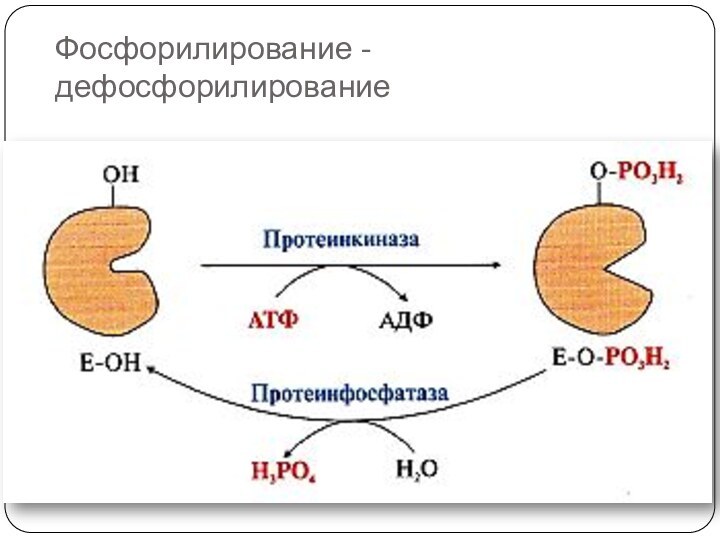
Фосфорилирование и дефосфорилирование
Частичный протеолиз
Аллостерическая регуляция
Слайд 36
Ассоциация-диссоциация протомеров
Слайд 37
Фосфорилирование -дефосфорилирование
Слайд 38
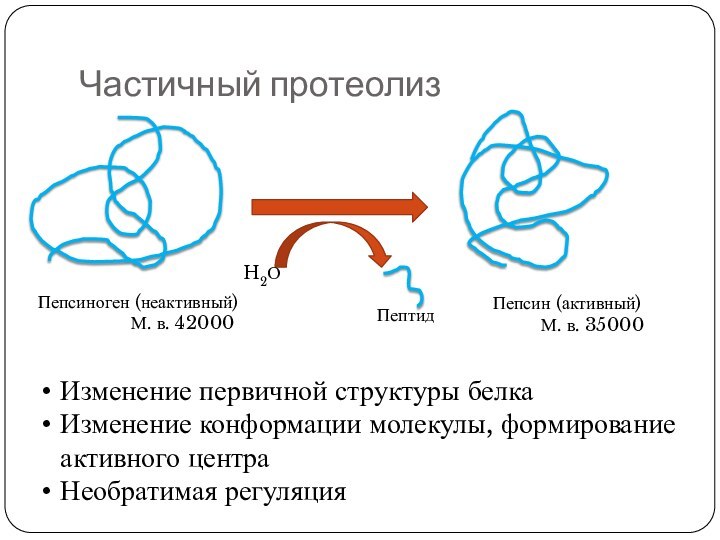
Частичный протеолиз
Изменение первичной структуры белка
Изменение конформации молекулы, формирование
активного центра
Необратимая регуляция
Слайд 40
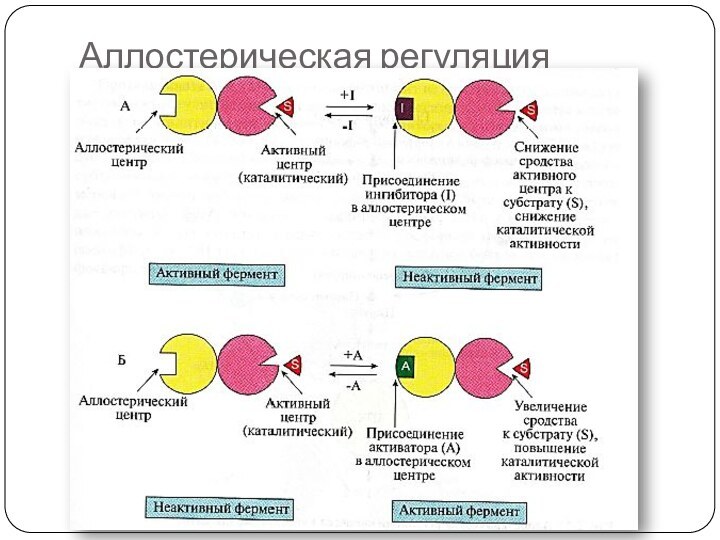
Аллостерические ферменты
Олигомерные белки (2 и более субъединиц)
Имеют аллостерический
центр (один или несколько)
Активный и аллостерический центры находятся в
разных протомерах
Регуляторы активности - эффекторы (активаторы, ингибиторы)
Изменение конформации регуляторного протомера приводит к изменению конформации молекулы в целом
Катализируют ключевые реакции
Аллостерическая регуляция обратима
ПРИМЕРЫ эффекторов:
продукты реакции, а также ATP/ADP, NAD+/ NADH
Слайд 41
Ингибиторы ферментов
Ингибиторы – вещества, снижающие каталитическую активность фермента
По
типу химической связи:
обратимые (слабые связи)
необратимые (ковалентная связь)
По механизму действия:
конкурентные
неконкурентные
Слайд 42
Конкурентные ингибиторы
Структурные аналоги субстратов
Связываются в активном центре фермента
Формируется
комплекс EI
Не изменяют структуры фермента
Продукт реакции не образуется
Ингибитор вытесняется
из активного центра фермента при увеличении концентрации субстрата
Снижают скорость реакции, но не изменяют Vmax. Почему?
«Изменяют» (повышают) Кm. В чем состоит условность «изменения» Кm?
Слайд 43
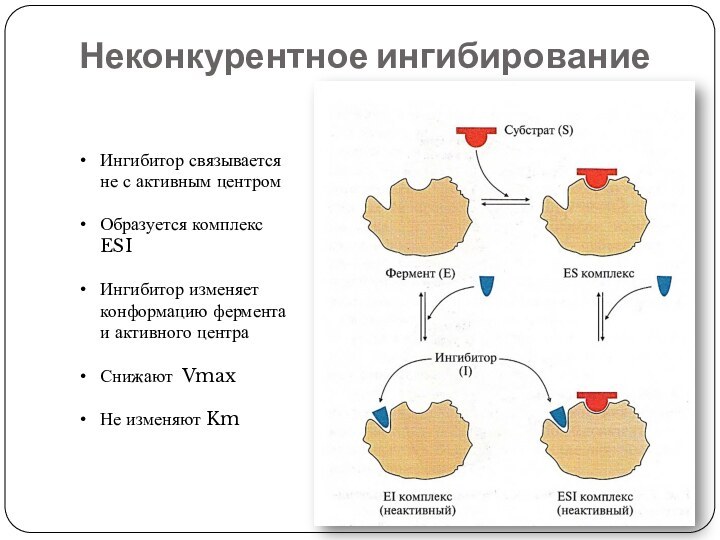
Неконкурентное ингибирование
Ингибитор связывается не с активным центром
Образуется комплекс
ESI
Ингибитор изменяет конформацию фермента и активного центра
Снижают Vmax
Не изменяют
Km
Слайд 44
Задание для самостоятельной работы
1. Используя материал слайдов лекции,
закончите таблицу:
2. Используя интернет сайты, найдите информацию о
лекарственных препаратах, механизм действия которых связан с ингибированием активности ферментов. Приведите примеры лекарственных препаратов.
Слайд 46
Заключение
Основа физиологических процессов – биохимические реакции
Скорость биохимических реакций
в организме катализируют белки-ферменты, многие из которых нуждаются в
кофакторах- микроэлементах и производных витаминов
Ферментам свойственна высокая каталитическая эффективность, специфичность действия, конформационная лабильность, способностью осуществлять катализ в «мягких» условиях внутренней среды организма
Активность ферментов регулируется. Это свойство ферментов является основой регуляции метаболических процессов в организме


































![Лекции: ЭНЗИМОЛОГИЯ Литература1. Березов Т.Т. Биологическая химия: учебник для студ. мед. ВУЗов [Рекомендовано УМО]](/img/tmb/13/1288219/bc0fa322aad350d57a0533a042f6b040-720x.jpg)





























