Слайд 2
Цель, задачи
Цель: ознакомиться с основными методами очистки сточных
вод от ионов марганца, железа и хрома.
Задачи:
1)ознакомиться
с видами сточных вод и методами их очистки от ионов тяжелых металлов (Mn, Cr)
2) систематизировать в рамках работы источники загрязнения
3) описать методы очистки от ионов марганца и хрома (реагентный метод, методы электрокоагуляции и гальванокоагуляции, метод очистки перманганатом калия и способ очистки от ионов марганца (по Фрогу))
4) подробно разобрать применение данных методов в очистке СВ от ионов марганца и хрома
Слайд 3
Марганец
Марганец (лат. Manganum), d-элемент VII группы периодической
системы, с конфигурацией валентных электронов 3d54s2.
Образует соединения в
степенях окисления от +2 (валентность II) до +7 (валентность VII), наиболее устойчивы соединения, в которых марганец проявляет степени окисления +2 и +7. У марганца, как и у многих других переходных металлов, известны также соединения, содержащие атомы марганца в степени окисления 0. принадлежит к числу переходных металлов.
Большая концентрация марганца в организме человека вызывает заболевания (в основном, ЦНС)
Слайд 4
Хром
Хром — (от греч. chroma цвет, краска) Cr, химический
элемент VI группы периодической системы Менделеева. Внешняя электронная конфигурация атома
хрома 3d5 4s1. В соединениях обычно проявляет степени окисления +2, +3, +6, среди них наиболее устойчивы Cr3+.
Хром – обязательный компонент нержавеющих, кислотоупорных, жаростойких сталей и большого числа других сплавов (нихромы, хромали, стеллит). Применяется для хромирования. Соединения хрома - окислители, неорганические пигменты, дубители.
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. Снижение содержания Х. в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови и снижению чувствительности периферийных тканей к инсулину.
Слайд 5
Марганец в компактном виде — твердый серебристо-белый металл.
Хром
– металл голубовато-стального цвета
Слайд 6
Источники загрязнения сточных вод тяжелыми металлами
Источниками загрязнения служат
сточные воды:
-Гальванических цехов
-Предприятий горнодобывающей, черной и цветной металлургии,
машиностроительных заводов.
-Тяжелые металлы входят в состав удобрений и пестицидов и могут попадать в водоемы вместе со стоком с сельскохозяйственных угодий.
Слайд 7
Анализ методов очистки сточных вод от ионов тяжелых
металлов
Принцип рационального природопользования предусматривает минимизацию потребления свежей воды на
технологические нужды за счет высокоэффективной очистки сточных вод и организации оборотного водоснабжения.
Рассмотрим некоторые методы очистки сточных вод от ионов Mn и Cr (VI), к ним относятся:
1. Реагентный метод
2. Метод гальванокоагуляции
3. Метод электрокоагуляции
4. Очистка воды перманганатом калия
5. Способ очистки воды от марганца (по Фрогу)
Слайд 8
Реагентный метод
Очистка сточных вод от ионов тяжелых металлом
осуществляется путем перевода ионов тяжелых металлов в малорастворимые соединения
(гидроксиды или основные карбонаты) при нейтрализации сточных вод с помощью различных щелочных реагентов. При нейтрализации кислых сточных вод известковым молоком, а также растворами соды некоторые ионы тяжелых металлов осаждаются в виде соответствующих основные карбонатов.
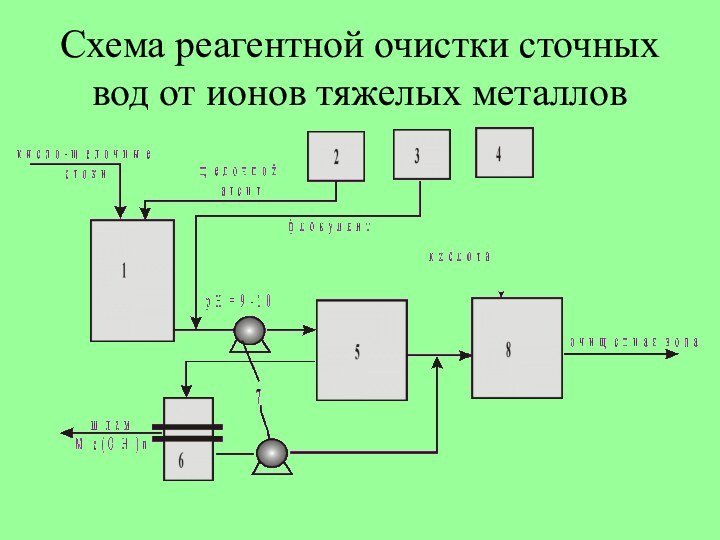
Слайд 9
Схема реагентной очистки сточных вод от ионов тяжелых
металлов
Слайд 10
Очистка от ионов хрома
восстановление сульфитом натрия
Cr2O72-
+3SO32- +8H+ = 2Cr3+ + 3SO42- + 4H2O
восстановление бисульфитом
натрия
Cr2O72- +3HSO3- +5H+ = 2Cr3+ + 3SO42- + 4H2O
восстановление пиросульфитом натрия
Cr2O72- +3S2O52- +10H+ = 4Cr3++ 6SO42- + 5H2O
восстановление дитионитом натрия
Cr2O72- +3S2O42- +6H+ = 2Cr3+ + 2SO42- + 3H2O
Слайд 11
Очистка от ионов хрома
Cr2O72- +6Fe2+ +14H+ = 6Fe3+
+ 2Cr3+ + 7H2O
Cr2O72- +3Fe(OH)2 +4H2O = Cr(OH)3
+ 3Fe(OH)3 + 2OH-
Слайд 12
Метод гальванокоагуляции
Метод основан на электрохимической обработке сточных вод
в электрическом поле и под действием электрического тока, возникающем
при переменном контакте гальванопары, состоящей из электродов, имеющих различные стандартные потенциалы (Е0н) в водных растворах.
Слайд 14
Гальванокоагуляция
Эффективность зависит от рН среды (предпочтительна кислая
среда), от дозы коагулянта (количество гальванопар), от условий перемешивания.
при
рН<5,5: Cr2O72- +6Fe2+ +14H+ = 6Fe3+ + 2Cr3+ + 7H2O
при pH>5,5: Cr2O72- +3Fe(OH)2 +4 H2O = Cr(OH)3 + 3Fe(OH)3 + 2OH-
Слайд 15
Метод электрокоагуляции
Методо электрокоагуляции основан на их электролизе с
использованием стальных или алюминиевых анодов, подвергающихся электролитическому растворению
Слайд 16
Параллельные процессы
электрофорез
катодное восстановление растворенных в стоках органических и
неорганических веществ или их химическое восстановление, а также образование
катодных осадков металлов
флотация твердых эмульгированных частиц обрабатываемой сточной воды пузырьками газообразного водорода, выделяющегося на катоде
сорбция ионов и молекул растворенных примесей стоков, а также частиц эмульгированных в воде примесей на поверхности гидроксидов железа и алюминия, которые обладают значительной сорбционной способностью.
Слайд 17
Электрокоагуляция
К минусам данного метода относится то, что
в процессе образуются гальваношламы. Процесс необходимо проводить в присутствии
хлорид-ионов для снижения поляризации электрода
Al2O3+HCl = HCl+H2O+Al
Cr2O72-+6Fe2+=6Fe3++2Cr3+
Слайд 18
Электрокоагуляционная установка для очистки сточных вод от
Слайд 19
Очистка воды перманганатом калия
Сущность метода заключается в том,
что при аэрации воды удаляется часть углекислоты и происходит
насыщение воды кислородом воздуха. При удалении углекислоты значение рН воды возрастает, что способствует ускорению процессов окисления и гидролиза железа и частично марганца с образованием соответствующих гидроокисей железа и марганца, а также их коагуляцией. Двухвалентный марганец медленно окисляется в трех- и четырехвалентный растворенным в воде кислородом воздуха. Окисление двухвалентного марганца с практически необходимой скоростью происходит при рН = 9...9,5. При таких значениях рН образующаяся гидроокись марганца выпадает в осадок в виде Мп(ОН)3 и Мп(ОН)4.
Слайд 20
Очистка воды перманганатом калия
При фильтровании содержащей марганец аэрированной
и подщелоченной воды через песчаный фильтр на поверхности зерен
песка выпадает отрицательно заряженный осадок Мn(ОН)4, который адсорбирует положительно заряженные ионы Мn2+. Эти ионы гидролизуются и реагируют с ранее выпавшим осадком, образуя постепенно Мn2О3 по реакции:
Мn(О2Н)4 + Мn(ОН)2 = Мn2O3 + ЗН2О.
Слайд 21
Очистка воды от марганца
Процесс окисления двухвалентного марганца в
трех- и четырехвалентный резко ускоряется, если аэрированную воду фильтруют
через контактный фильтр, загруженный дробленым природным минералом пиролюзитом МnO2-Н2O, либо через обычный кварцевый песок, предварительно обработанный окислами марганца («черный песок»). Пиролюзит и «черный песок» в данном случае играют роль катализаторов, ускоряющих процесс окисления марганца.
Слайд 22
Способ очистки воды от марганца (по Фрогу)
Метод применим
при окисляемости исходной воды до 9,5 мг Ог/л. Это
применение более сильного окислителя - ГПХ. Это повышение значения рН воды методом глубокой аэрации, последующее фильтрование, удаление свободной углекислоты, рН повышается до 8-8,5. Необходимо присутствие в воде Fe2+, которое при окислении растворенным О2 образует гидроксид железа, адсорбирующий Мn2+/ Слабый окислитель (кислород) в присутствии более сильного (хлора) активизируется. Для осуществления этого метода требуется соблюдение соотношения Fe2+/Mn2+ - 10. Процесс деманганации воды зависит от ее температуры, pН, окисляемости, присутствия силикатов, соотношения Fe(ll)/Mn(II) – 10.