- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Общая химия
Содержание
- 2. Химия - наука о веществах и их превращениях в тех или иных химических системах
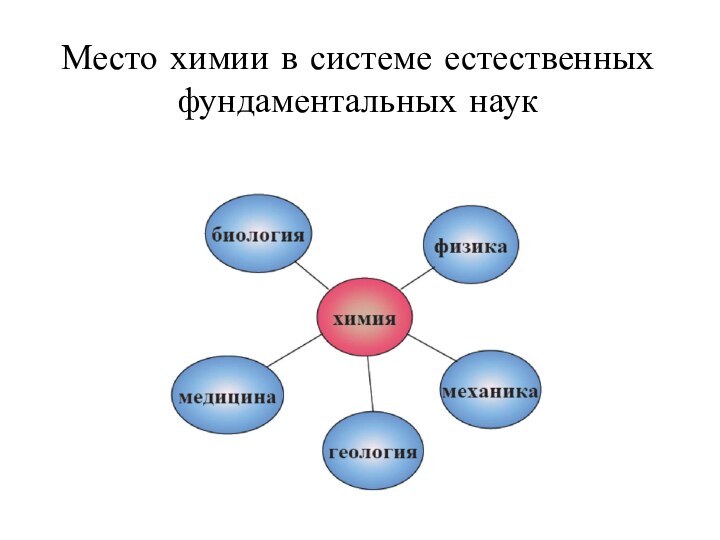
- 3. Место химии в системе естественных фундаментальных наук
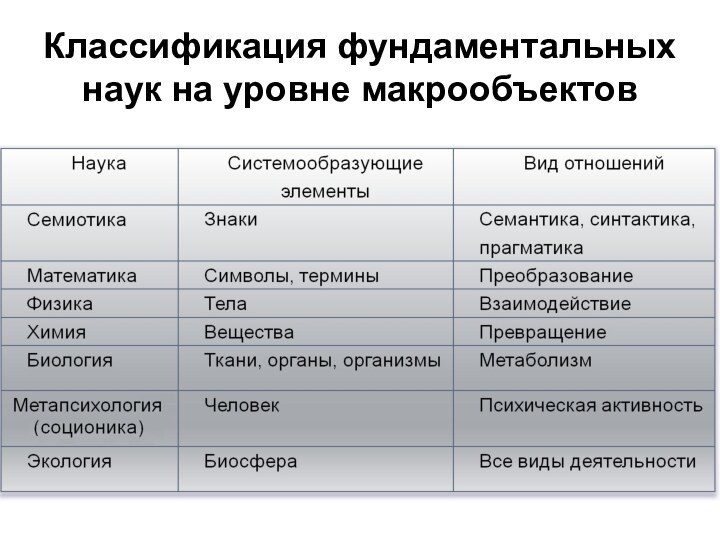
- 4. Классификация фундаментальных наук на уровне макрообъектов
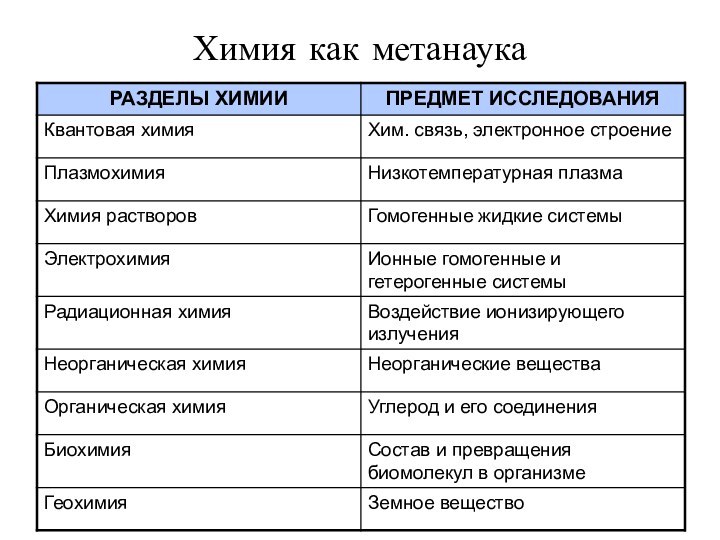
- 5. Химия как метанаука
- 6. Атом - наименьшая частица химическогоэлемента, являющаяся носителем
- 8. Аллотропия - существование одного и
- 9. Аллотропы углеродаa) алмазb) графитc) лонсдейлит d) С60
- 10. Сложное вещество - это химическоевещество, которые состоит
- 11. Молекулярная формула соединенияСтехиометрический коэффициент -количество вещества того
- 12. Химическая система – совокупность микро- или макроколичеств
- 13. Классификация химических систем (по типу протекающих химических реакций) ОбменныеКислотно-основные Окислительно-восстановительные (ОВР)
- 14. Среда: Кислая
- 15. Характеристика химических системИоны – частицы реального вещества,
- 16. Двойственность химических свойств гидроксида алюминияАмфотерность алюминия:
- 17. Двойственность химических свойств пероксида водорода
- 18. Химические превращения - такие превращения, при которых
- 19. Химические превращения Химические превращения – это
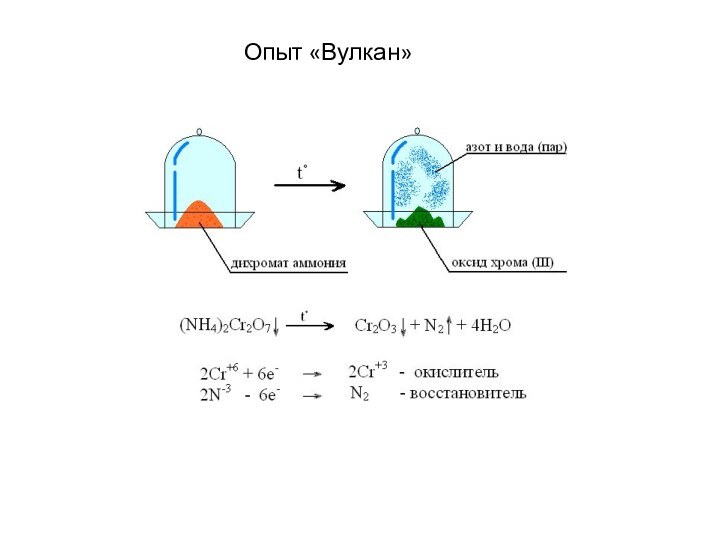
- 20. Опыт «Вулкан»
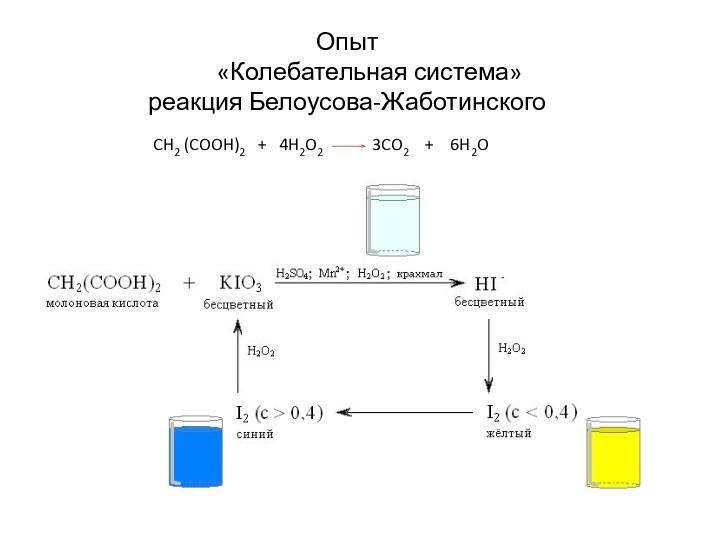
- 21. Опыт «Колебательная
- 22. 1 стакан Водные растворы соли сульфата церия(III),
- 23. Составление ионных уравнений Многие молекулы в воде
- 24. Примеры диссоциации молекул на ионы Ba(NO3)2
- 25. Составление ионных уравнений В водном растворе не
- 26. Примеры составления ионных уравнений 5H2O2 + 2KMnO4
- 27. Степень окисления и структурные формулы Степень окисления
- 28. Скачать презентацию
- 29. Похожие презентации





















Слайд 6
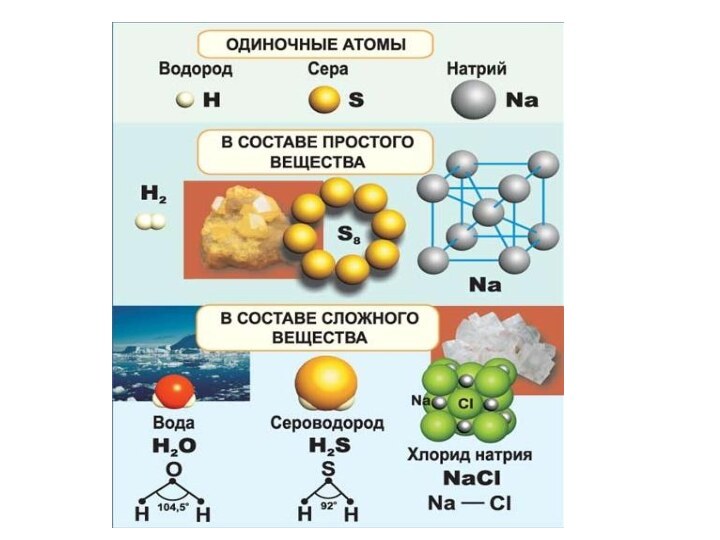
Атом - наименьшая частица химического
элемента, являющаяся носителем его
свойств
Элемент - совокупность атомов
с одинаковым зарядом ядра
Простое вещество -
вещество,состоящее из атомов одного и того же
химического элемента
Слайд 8 Аллотропия - существование одного и того
же химического элемента в виде двух и более простых
веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм
Слайд 9
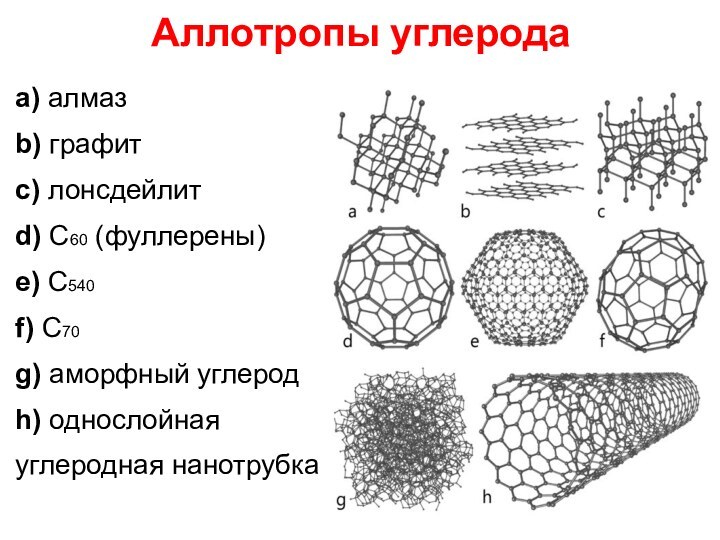
Аллотропы углерода
a) алмаз
b) графит
c) лонсдейлит
d) С60 (фуллерены)
e) С540
f) C70
g) аморфный углерод
h) однослойная
углеродная нанотрубка
Слайд 10
Сложное вещество - это химическое
вещество, которые состоит из
атомов двух
или более различных химических
элементов.
Молекула - наименьшая частица вещества,
несущая
его химические свойства. Состоит из двух или более атомов;
характеризуется коли-
чеством входящих в неё
атомных ядер и электронов,
а также определённой
структурой.
Слайд 11
Молекулярная формула соединения
Стехиометрический коэффициент -
количество вещества того или
иного элемента,
входящего в состав молекулы.
Стехиометрические соединения - соединения,
коэффициенты
которых являются целыми числами(Н2О, С2Н5ОН, H2SO4)
Нестехиометрические соединения - соединения,
коэффициенты которых являются дробными
числами.
Слайд 12
Химическая система –
совокупность микро- или
макроколичеств веществ,
способных при изменении
концентрации или параметров состояния
к превращению
с образованием новых химических соединений.
хим. превращения
Σ Bi Σ Bj
реагенты продуты
(исходные вещества) (конечныевещества)
факторы
(условия)
Слайд 13
Классификация химических систем
(по типу протекающих химических реакций)
Обменные
Кислотно-основные
Окислительно-восстановительные (ОВР)
Слайд 14 Среда: Кислая
Нейтральная
Щелочная[H+]: 100 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14
рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
Увеличение кислотности Увеличение щелочности
Слайд 15
Характеристика химических систем
Ионы – частицы реального вещества, одноатомные
или многоатомные, несущие на себе электрический заряд (Na+, Cl-
, SO42-, Cr2O72- и т.д.)Металлы. Металлами является большинство химических элементов (примерно 90 %). Пример: Na, K, Mg, Ca, Ba.
Неметаллы. Элементы с типично неметаллическими свойствами занимают правый верхний угол периодической системы.
Основное различие между металлами и неметаллами заключается в том, что металлы проводят ток, а неметаллы не проводят
Слайд 16
Двойственность химических свойств гидроксида алюминия
Амфотерность алюминия:
(pH < 7)
Al(OH)3 + 3HCl AlCl3 + 3H2O
гидроксид алюминия, проявляя основные свойства, взаимодействует с кислотой и образует соль. (Al3+ выступает в роли катиона)
(pH >7)
Al(OH)3 + 3NaOH Na3AlO3 + 3H2O
гидроксид алюминия, выступая как кислота, реагирует со щёлочью, образуя соль. (AlO33- выступает в роли аниона)
Слайд 17
Двойственность химических свойств пероксида водорода
Проявление
свойств восстановителя или окислителя пероксида:
(pH < 7)5H2O2 + 2KMnO4 + 3H2SO4 5O2 + K2SO4 + 2MnSO4 + 8H2O
Mn+7 + 5e- Mn+2 2
2O- – 2e- O2 5
В данной реакции кислород в пероксиде отдаёт электроны и является восстановителем;
(pH > 7)
H2O2 + 2KI + H2SO4 I2 + K2SO4 + 2 H2O
2I- – 2e- I2 1
2O-+ 2e- 2O2- 1
В данной реакции кислород в пероксиде принимает электроны и является окислителем.
Слайд 18 Химические превращения - такие превращения, при которых происходят
изменения только во внешних электронных слоях атомов, не затрагивая
внутренних слоёв и ядра. Реакции, при которых происходят химические превращения, бывают:
Соединения:
Замещения:
Разложения:
Обмена:
Слайд 19
Химические превращения
Химические превращения – это такие
превращения, при которых происходят изменения только во внешних электронных
слоях атомов, не затрагивая внутренних электронных слоёв и ядра.Основные признаки химических превращений:
1). Выделение газа ( ↑ )
2). Выпадение осадка ( ↓ )
3). Выделение или поглощение тепла ( ±Q )
4). Изменение цвета как результат изменения степеней
окисления.
Слайд 22
1 стакан Водные растворы соли сульфата церия(III),
бромата
калия KBrO3 и броммалоновой кислоты
HO(O)C-CH(Br) – C(O)OH.
Реакционная масса подкисленасерной кислотой.
2 стакан Вместо церия – железо
3 стакан Вместо броммалоновой кислоты – лимонная. Катализатор – соли марганца
4 стакан Щавелево-уксусная кислота с солями церия
Примеры колебательных реакций
Слайд 23
Составление ионных уравнений
Многие молекулы в воде
диссоциируют на ионы. Химические соединения, которые хорошо растворяются в
воде, делятся на сильные электролиты (полностью распадаются на ионы) и слабые электролиты (частично распадаются на ионы).При написании ионного уравнения разбиваем на ионы:
Растворимые соли (NaCl, Na3PO4 и др. )
Сильные кислоты ( часто встречаемые в учебном курсе : H2SO4, HNO3, HCl , HBr , HI , HClO4 )
Сильные основания (LiOH , NaOH , KOH, RbOH , CsOH , FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2 )
Слайд 24
Примеры диссоциации молекул на ионы
Ba(NO3)2
Ba2+ + 2NO3–
K2Cr2O7 2K+ + Cr2O72-
KMnO4 K+ + MnO4–
NaH2PO4 Na+ + H2PO4–
AlOHSO4 AlOH2+ + SO42-
H2SO4 2H+ + SO42-
Ca(OH)2 Ca2+ + 2OH-
Слайд 25
Составление ионных уравнений
В водном растворе не
расписываем на ионы:
Простые вещества: H2, N2 Fe и
др. Оксиды (CO, Na2O и др. )
2. Газы (Cl2, CO2 и др.)
3. Осадки (AgCl, BaSO4 и др.)
4. Слабые электролиты (H2O, H2O2),
слабые кислоты (H2SO3, H3PO4 и др.),
слабые основания (NH4OH, Fe(OH)3 и др.)
Слайд 26
Примеры составления ионных уравнений
5H2O2 + 2KMnO4 +
3H2 SO4 5O2 + K2 SO4
+ 2Mn SO4 + 8H2O5H2O2 + 2MnO4- + 6H+ 5O2 + 2Mn2+ + 8H2O
Проверка: слева суммарный заряд = + 4 и справа суммарный заряд = +4
H2O2 + 2K I + H2 SO4 I2 + K2 SO4 + 2H2O
H2O2 + 2I- + 2H+ I2 + 2H2O
Проверка: слева суммарный заряд = 0 и справа суммарный заряд = 0
Слайд 27
Степень окисления и структурные формулы
Степень окисления –
это условный электрический заряд атомов в молекуле, возникающий из-за
смещения электронов в сторону более электроотрицательного атома.Структурные формулы:
Оксиды и пероксиды:
+ -2 + -2 +
H2O H – O – H
+2 -2 +2 -2
BaO Ba = O
+3 -2 -2 +3 -2 +3 -2
Al2O3 O = Al – O – Al = O