- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основы органической химии
Содержание
- 2. Алкины Алкины (ацетиленовые углеводороды) – непредельные
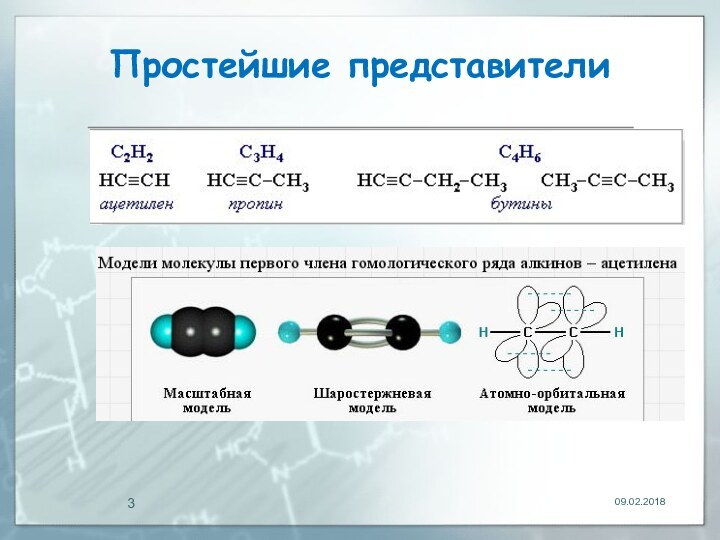
- 3. Простейшие представители
- 4. Алкины Тройную связь осуществляют шесть общих электронов:
- 5. Строение С=С связиКаждый из атомовимеет по три
- 6. Получение алкиновПолучение и свойства ацетилена.Уравнения реакций:(видеоролик exp5.exe в папке лабораторные опыты)Опишите роль каждого реактива в опытах
- 7. Строение С≡С связиТройная связь является комбинацией из
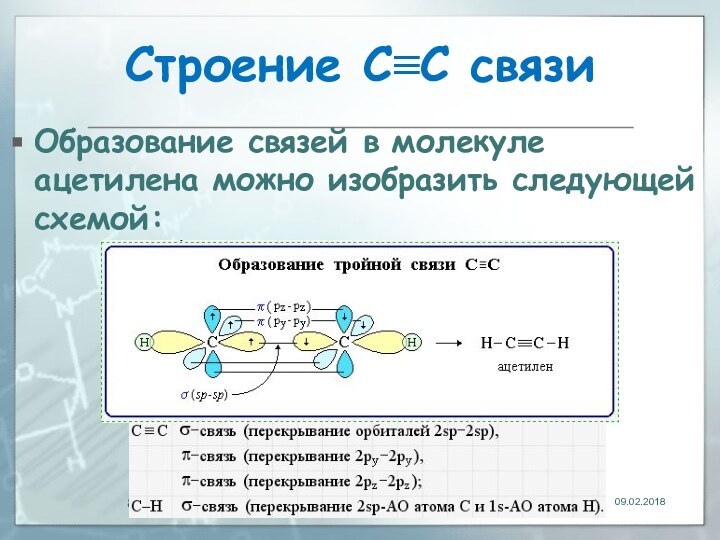
- 8. Строение С≡С связиОбразование связей в молекуле ацетилена можно изобразить следующей схемой:
- 9. Строение С≡С связиπ-Cвязи располагаются во взаимно перпендикулярных
- 10. Номенклатура алкиновназвания алкинов производят от названий соответствующих
- 11. Номенклатура алкиновНумерацию углеродных атомов начинают с ближнего
- 12. Номенклатура алкиновДля простейших алкинов применяются исторически сложившиеся
- 13. Номенклатура алкиновЕсли кроме тройной связи в молекуле есть двойные связи, то они будут иметь наименьшее число:
- 14. Назовите следующие алкины:CH2≡CH2CH3—CH ≡ CH2CH3—CH3—CH ≡ CH2CH3—CH
- 15. Структурная изомерия алкинов1. Изомерия положения тройной связи (начиная с С4Н6):
- 16. Структурная изомерия алкинов2. Изомерия углеродного скелета (начиная с С5Н8):
- 17. Структурная изомерия алкинов3. Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:
- 18. Пространственная изомерия алкиновПространственная изомерия относительно тройной связи
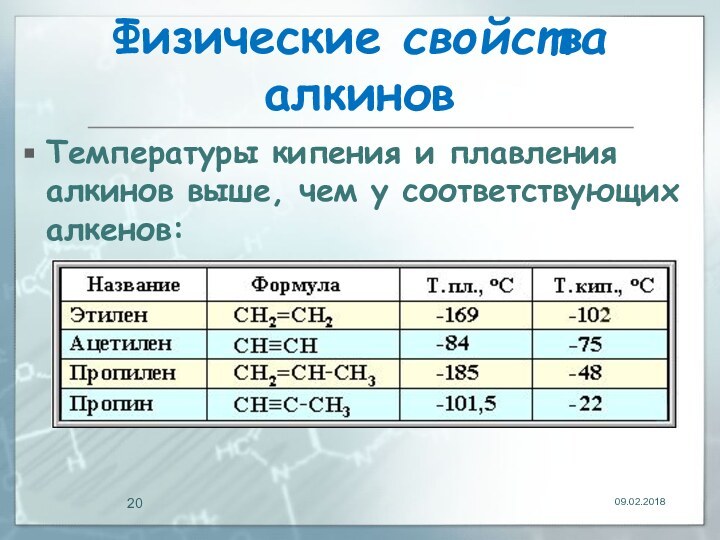
- 19. Физические свойства алкиновТемпературы кипения и плавления ацетиленовых
- 20. Физические свойства алкиновТемпературы кипения и плавления алкинов выше, чем у соответствующих алкенов:
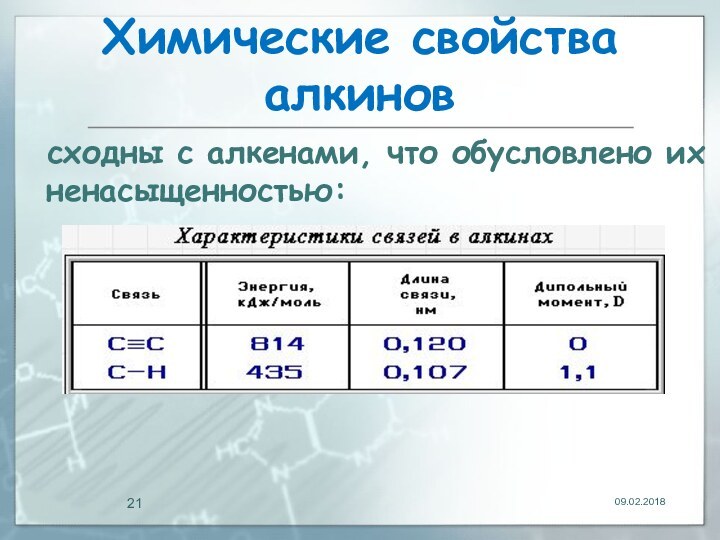
- 21. Химические свойства алкиновсходны с алкенами, что обусловлено их ненасыщенностью:
- 22. Гидрирование (присоединение водорода)В присутствии металлических катализаторов
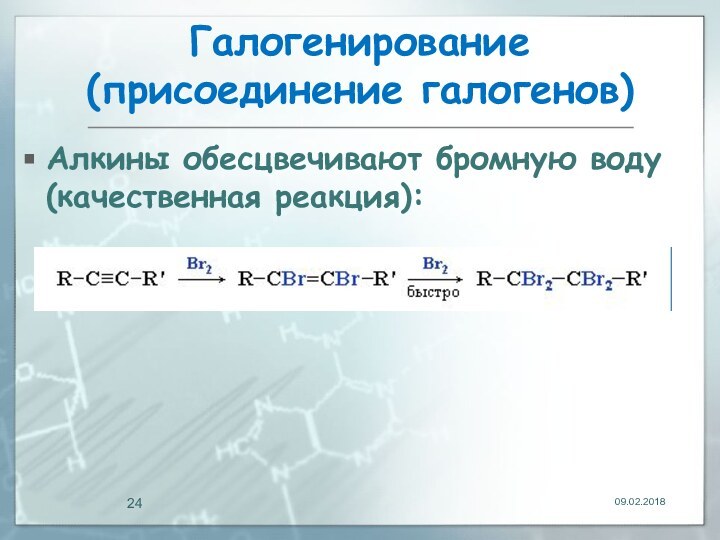
- 23. Галогенирование (присоединение галогенов)Электрофильное присоединение галогенов к
- 24. Галогенирование (присоединение галогенов)Алкины обесцвечивают бромную воду (качественная реакция):
- 25. Гидрогалогенирование (присоединение галогеноводородов)Присоединение галогеноводородов также идет по
- 26. Гидрогалогенирование (присоединение галогеноводородов)Гидрохлорирование ацетилена используется в одном
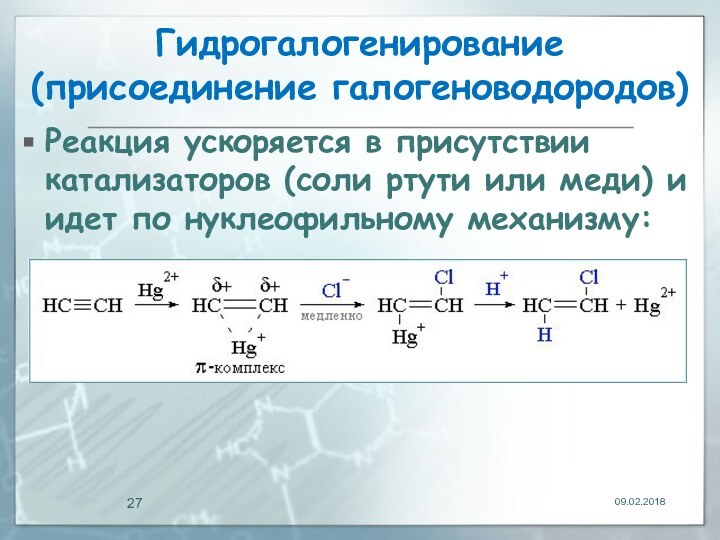
- 27. Гидрогалогенирование (присоединение галогеноводородов)Реакция ускоряется в присутствии катализаторов (соли ртути или меди) и идет по нуклеофильному механизму:
- 28. Гидратация (реакция Кучерова)Присоединение воды происходит в
- 29. Гидратация (присоединение воды)или в кетон (в случае других алкинов) по нуклеофильному механизму :
- 30. Полимеризация алкинов1. Димеризация под действием водно-аммиачного раствора меди (CuCl):
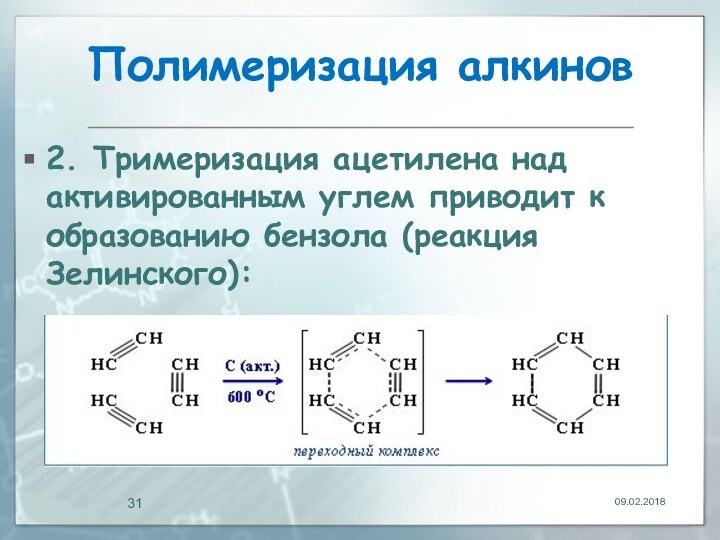
- 31. Полимеризация алкинов2. Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
- 32. Полимеризация алкинов3. Реакция полимеризации с образованием циклических или линейных молекул:
- 33. Полимеризация алкинов4. окислительная поликонденсация ацетилена в присутствии
- 34. Образование солейАлкины-1 вследствие полярности связи С(sp)-Н проявляют
- 35. Образование солейЕсли тройная связь находится не на
- 36. Окисление алкиновАцетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:
- 37. Окисление алкиновАлкины обесцвечивают раствор KMnO4, что используется для их качественного определения:
- 38. Окисление алкиновПри сгорании (полном окислении) ацетилена выделяется
- 39. Получение алкинов I. Термический крекинг (пиролиз) метана :
- 40. Получение алкенов II. Отщепление (элиминирование) двух атомов
- 41. Получение алкинов II. Гидролиз карбида кальция :Карбид
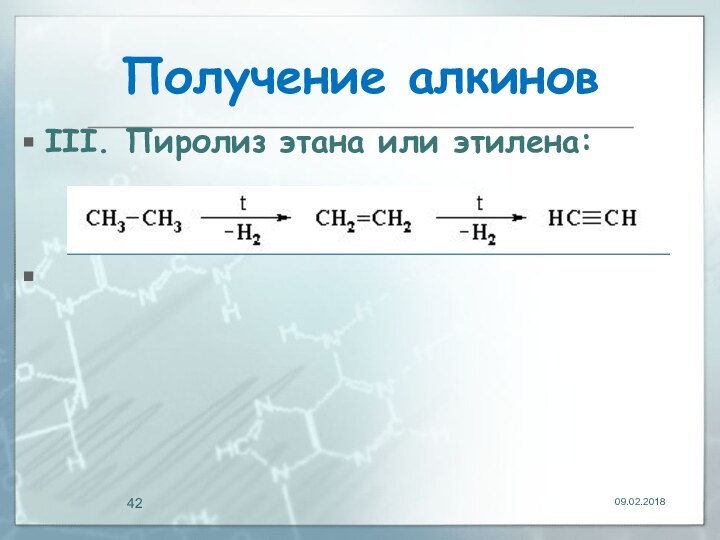
- 42. Получение алкинов III. Пиролиз этана или этилена:
- 43. Применение алкинов Алкины применяются в качестве исходных
- 44. Применение алкинов Наибольшее практическое значение имеют ацетилен и винилацетилен (бутен-3-ин-1).
- 45. Применение алкинов Винилацетилен является важным промежуточным продуктом в производстве масло- и бензостойкого синтетического хлоропренового каучука:
- 46. 1.Контрольная работаНазовите и нарисуйте приведенные соединения. Какие
- 47. 2. Контрольная работаДайте названия следующих алкинов, полученных
- 48. 3.Контрольная работаТройная связь является сочетанием: Ответ
- 49. 4. Контрольная работаКакова гибридизация атомов углерода в
- 50. 5. Контрольная работаИзомерами 3-метилпентина-1 являются:Ответ 1 :
- 51. 6. Контрольная работаВзрывчатое вещество образуется в реакции:Ответ
- 52. 7. Контрольная работаИз технического карбида кальция массой
- 53. 8. Контрольная работаУкажите продукт Z в схеме
- 54. Сравните получение алканов, алкенов, алкинов, проанализировав видеоролики из папки «Лабораторные опыты».
- 55. Получение алкановПолучение и свойства метана(видеоролик exp3.exe в папке лабораторные опыты)
- 56. Получение алкановПолучение и свойства метана.Уравнения реакций:Опишите роль каждого реактива в опытах
- 57. Свойства алкановВзаимодействия алканов с бромом.Уравнения реакций:(видеоролик exp2.exe в папке лабораторные опыты)Опишите роль каждого реактива в опытах
- 58. Получение алкеновПолучение и свойства этилена.Уравнения реакций:(видеоролик exp4.exe в папке лабораторные опыты)Опишите роль каждого реактива в опытах
- 59. Скачать презентацию
- 60. Похожие презентации
Алкины Алкины (ацетиленовые углеводороды) – непредельные алифатические углеводороды, молекулы которых содержат одну тройную связь.Общая формула алкинов:


















































Слайд 2
Алкины
Алкины (ацетиленовые углеводороды) – непредельные алифатические
углеводороды, молекулы которых содержат одну тройную связь.
Слайд 4
Алкины
Тройную связь осуществляют шесть общих электронов:
В
образовании тройной связи участвуют атомы углерода в sp-гибридизованном состоянии.
Слайд 5
Строение С=С связи
Каждый из атомовимеет по три 2sp2-гибридных
орбитали, направленных друг к другу под углом 120°, и
одну негибридизованную 2р-орбиталь, расположенную под углом 90° к плоскости гибридных АО:
Слайд 6
Получение алкинов
Получение и свойства ацетилена.
Уравнения реакций:
(видеоролик exp5.exe в
папке лабораторные опыты)
Опишите роль каждого реактива в опытах
Слайд 7
Строение С≡С связи
Тройная связь является комбинацией из одной
σ-и двух π-связей, образуемых двумя sp-гибридизованными атомами.
σ-связь возникает при
осевом перекрывании sp-гибридных орбиталей соседних атомов углерода; одна из π -связей образуется при боковом перекрывании рy-орбиталей, другая – при боковом перекрывании
рz-орбиталей.
Слайд 8
Строение С≡С связи
Образование связей в молекуле ацетилена можно
изобразить следующей схемой:
Слайд 9
Строение С≡С связи
π-Cвязи располагаются во взаимно перпендикулярных плоскостях.
σ-Cвязи, образуемые sp–гибридными орбиталями углерода, располагаются на одной прямой
(под углом 180° друг к другу).Поэтому молекула ацетилена имеет линейное строение:
Слайд 10
Номенклатура алкинов
названия алкинов производят от названий соответствующих алканов
(путем замены суффикса –ан на –ин:
2 атома С
→ этан → этин;
3 атома С →пропан → пропин Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь.
Слайд 11
Номенклатура алкинов
Нумерацию углеродных атомов начинают с ближнего к
тройной связи конца цепи.
Цифра, обозначающая положение тройной связи,
ставится обычно после суффикса –ин.Например:
Слайд 12
Номенклатура алкинов
Для простейших алкинов применяются исторически сложившиеся названия:
ацетилен (этин), аллилен (пропин), кротонилен (бутин-1), валерилен (пентин-1).
В номенклатуре
наиболее часто используются следующие одновалентные радикалы алкинов:
Слайд 13
Номенклатура алкинов
Если кроме тройной связи в молекуле есть
двойные связи, то они будут иметь наименьшее число:
Слайд 14
Назовите следующие алкины:
CH2≡CH2
CH3—CH ≡ CH2
CH3—CH3—CH ≡ CH2
CH3—CH ≡
CH—CH3
CH2 ≡ CH—CH=CH2
CH3—CH ≡ CH2
|
CH3
Слайд 17
Структурная изомерия алкинов
3. Межклассовая изомерия с алкадиенами и
циклоалкенами, начиная с С4Н6:
Слайд 18
Пространственная изомерия алкинов
Пространственная изомерия относительно тройной связи в
алкинах не проявляется,
заместители могут располагаться только одним способом
- вдоль линии связи
Слайд 19
Физические свойства алкинов
Температуры кипения и плавления ацетиленовых углеводородов
увеличиваются с ростом их молекулярной массы.
При обычных условиях
алкины С2Н2-С4Н6 – газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые вещества. Алкины плохо растворимы в воде, лучше – в органических растворителях.
Слайд 20
Физические свойства алкинов
Температуры кипения и плавления алкинов выше,
чем у соответствующих алкенов:
Слайд 22
Гидрирование
(присоединение водорода)
В присутствии металлических катализаторов (Pt, Ni)
алкины присоединяют водород с образованием алкенов (разрывается первая π-связь),
а затем алканов (разрывается вторая π -связь):
Слайд 23
Галогенирование
(присоединение галогенов)
Электрофильное присоединение галогенов к алкинам протекает
медленнее, чем для алкенов (первая p-связь разрывается труднее, чем
вторая):
Слайд 24
Галогенирование
(присоединение галогенов)
Алкины обесцвечивают бромную воду (качественная реакция):
Слайд 25
Гидрогалогенирование (присоединение галогеноводородов)
Присоединение галогеноводородов также идет по электрофильному
механизму.
Продукты присоединения к несимметричным алкинам определяются правилом Марковникова:
Слайд 26
Гидрогалогенирование (присоединение галогеноводородов)
Гидрохлорирование ацетилена используется в одном из
промышленных способов получения винилхлорида:
Винилхлорид является исходным веществом (мономером) в
производстве поливинилхлорида (ПВХ).
Слайд 27
Гидрогалогенирование (присоединение галогеноводородов)
Реакция ускоряется в присутствии катализаторов (соли
ртути или меди) и идет по нуклеофильному механизму:
Слайд 28
Гидратация
(реакция Кучерова)
Присоединение воды происходит в присутствии катализатора
соли ртути (II) и идет через образование неустойчивого непредельного
спирта, который изомеризуется в уксусный альдегид:
Слайд 29
Гидратация
(присоединение воды)
или в кетон (в случае других
алкинов) по нуклеофильному механизму :
Слайд 31
Полимеризация алкинов
2. Тримеризация ацетилена над активированным углем приводит
к образованию бензола (реакция Зелинского):
Слайд 32
Полимеризация алкинов
3. Реакция полимеризации с образованием циклических или
линейных молекул:
Слайд 33
Полимеризация алкинов
4. окислительная поликонденсация ацетилена в присутствии CuCl
(высокомолекулярное вещество – карбин образуется не в результате полимеризации
ацетилена):
Слайд 34
Образование солей
Алкины-1 вследствие полярности связи С(sp)-Н проявляют слабые
кислотные свойства: атомы водорода могут замещаться атомами металла.
При
этом образуются соли – ацетилениды:
Слайд 35
Образование солей
Если тройная связь находится не на конце
цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода)
и ацетилениды не образуются:
Слайд 36
Окисление алкинов
Ацетилен и его гомологи окисляются перманганатом калия
с расщеплением тройной связи и образованием карбоновых кислот:
Слайд 37
Окисление алкинов
Алкины обесцвечивают раствор KMnO4, что используется для
их качественного определения:
Слайд 38
Окисление алкинов
При сгорании (полном окислении) ацетилена выделяется большое
количества тепла:
Температура ацетиленово-кислородного пламени достигает 2800- 3000°С. На этом
основано применение ацетилена для сварки и резки металла. Ацетилен образует с воздухом и кислородом взрывоопасные смеси. В сжатом, и особенно в сжиженном, состоянии он способен взрываться от удара.
Слайд 40
Получение алкенов
II. Отщепление (элиминирование) двух атомов или
групп атомов от соседних атомов углерода с образованием между
ними π-связи двух типов:дегидратация
дегидрогалогенирование
Слайд 41
Получение алкинов
II. Гидролиз карбида кальция :
Карбид кальция
образуется при нагревании смеси оксида кальция СаО (жженой извести)
и кокса до 2500°С:
Слайд 43
Применение алкинов
Алкины применяются в качестве исходных продуктов
в производстве полимерных материалов (пластмасс, каучуков, пленок) и других
органических веществ.
Слайд 44
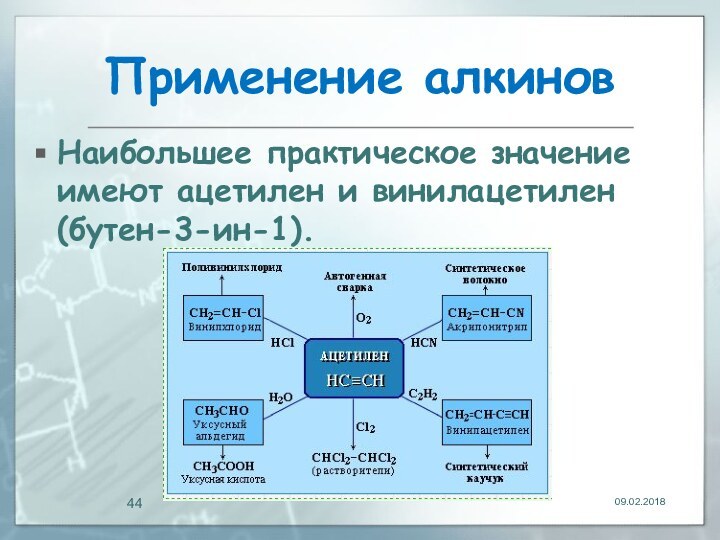
Применение алкинов
Наибольшее практическое значение имеют ацетилен и
винилацетилен (бутен-3-ин-1).
Слайд 45
Применение алкинов
Винилацетилен является важным промежуточным продуктом в
производстве масло- и бензостойкого синтетического хлоропренового каучука:
Слайд 46
1.Контрольная работа
Назовите и нарисуйте приведенные соединения. Какие из
них относятся к алкинам:
а)
б)
в)
г)
д)
Слайд 47
2. Контрольная работа
Дайте названия следующих алкинов, полученных из
алканов:
- бутан
- гептан
- октан
- пропан
- пентан- гексан





























