- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Планирование и проведение клинических исследований лекарственных средств. Исследования в педиатрии.
Содержание
- 2. Преобразование научных достижений в лекарственные средства для
- 3. Примерно 1 из 10 000 химических соединений
- 4. Данный процесс продолжается в среднем до 12–15
- 5. Создание новых лекарственных средств невозможно без соответствующих
- 6. По информации Департамента торговли и промышленности Великобритании,
- 7. Затраты на новое лекарство от синтеза молекулы
- 8. Исследования новых препаратов в классическом варианте проходят
- 9. фаза II — продолжительностью примерно 2 года
- 10. Проблемы применения лекарственных средств в педиатрии и необходимость их специального изучения
- 11. В настоящее время педиатрия не располагает достаточным
- 12. При отсутствии клинических исследований подавляющее большинство маленьких
- 13. Так, до 90% препаратов, назначаемых новорожденным, не
- 14. В конечном счете, в большинстве областей педиатрии
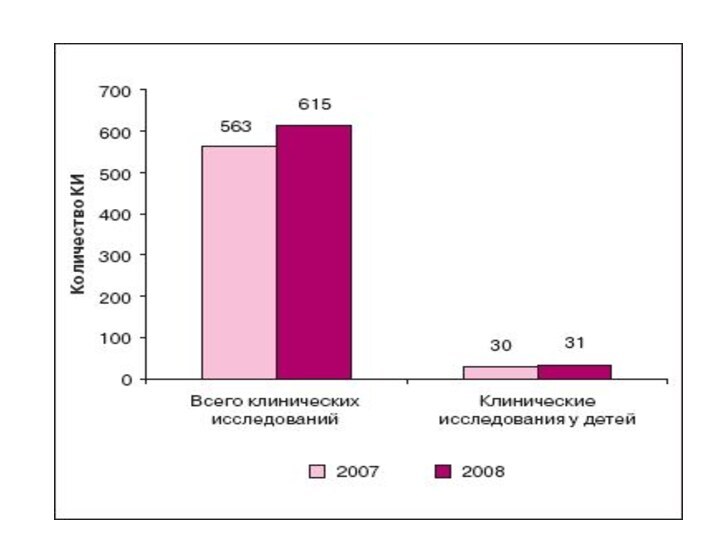
- 15. Клинические исследования у детей в Российской Федерации
- 16. В настоящее время проведение клинических исследований, в
- 17. «Не допускаются клинические исследования лекарственных средств на
- 18. В пункте 6 закон указывает, что «при
- 19. С 2004 по 2007 г. Федеральной Службой
- 21. Скачать презентацию
- 22. Похожие презентации
Преобразование научных достижений в лекарственные средства для практической медицины представляет собой очень сложный и крайне дорогостоящий процесс. Путь нового препарата от фармакологической лаборатории до аптечного прилавка долог и тернист.



















Слайд 3 Примерно 1 из 10 000 химических соединений проходит
полный цикл от его открытия до внедрения на рынок.
Из всех синтезированных соединений отбирают приблизительно 250 «кандидатов»; их необходимо изучить в эксперименте, чтобы получить примерно 5 претендентов на дальнейшие клинические исследования у человека и, в конечном счете, предложить на рынок хотя бы один лекарственный препарат.Слайд 4 Данный процесс продолжается в среднем до 12–15 лет,
причем фаза клинических исследований занимает около половины этого срока
Слайд 5 Создание новых лекарственных средств невозможно без соответствующих научных
исследований и разработок. Однако такие исследования являются чрезвычайно «дорогим
удовольствием».Слайд 6 По информации Департамента торговли и промышленности Великобритании, фармацевтическая
отрасль занимает 2-е место в мире по объемам инвестиций
в исследования и разработки лекарственных средств, опережая такие наукоемкие направления, как электроника и автомобилестроение.Слайд 7 Затраты на новое лекарство от синтеза молекулы до
выхода готового препарата на рынок составляют от 500 до
2 млн долларов, причем приблизительно одна треть этой суммы расходуется на клинические исследования.Слайд 8 Исследования новых препаратов в классическом варианте проходят следующие
фазы:
доклиническая — продолжительностью до 3,5 лет (лабораторные исследования, включая
тесты на животных, для оценки безопасности и биологической активности лекарственного вещества);фаза I — продолжительностью около 1 года (исследования у здоровых добровольцев для оценки безопасности препарата и определения его дозы)
Слайд 9 фаза II — продолжительностью примерно 2 года (исследования
у пациентов для оценки эффективности и безопасности лекарственного препарата
и определения его терапевтических доз);фаза III — продолжительностью до 3 лет (исследования на большом числе пациентов для подтверждения эффективности препарата и уточнения профиля его безопасности)





























