Слайд 2
Взаимодействие полимера с растворителем начинается с набухания. Набухание
– это самопроизвольный процесс поглощения низкомолекулярного растворителя полимером, сопровождающийся
увеличением его массы и объема. В процессе набухания различают две стадии.
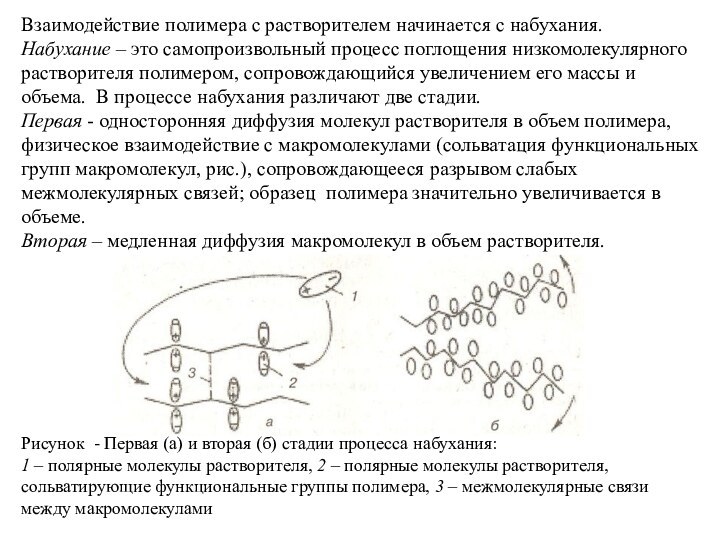
Первая - односторонняя диффузия молекул растворителя в объем полимера, физическое взаимодействие с макромолекулами (сольватация функциональных групп макромолекул, рис.), сопровождающееся разрывом слабых межмолекулярных связей; образец полимера значительно увеличивается в объеме.
Вторая – медленная диффузия макромолекул в объем растворителя.
Рисунок - Первая (а) и вторая (б) стадии процесса набухания:
1 – полярные молекулы растворителя, 2 – полярные молекулы растворителя, сольватирующие функциональные группы полимера, 3 – межмолекулярные связи между макромолекулами
Слайд 3
В соответствии с первой и второй стадиями различают
ограниченное и неограниченное набухание.
Ограниченное набухание заканчивается первой стадией,
самопроизвольного растворения полимера не происходит, так как цепи не могут быть полностью отдалены друг от друга; образуются две сосуществующие фазы: набухший полимер и чистый растворитель. Фазы разделены поверхностью раздела и находятся в равновесии.
а – система полимер-растворитель до набухания;
б, в – ограниченное набухание полимера
в растворителе
Неограниченное набухание сопровождается самопроизвольным растворением, т.е. образованием истинного раствора полимера. При медленной диффузии макромолекул в объем растворителя сначала возникает слой более разбавленного раствора, сосуществующий со слоем более концентрированного. Постепенно концентрации слоев выравниваются, образуется истинный раствор.
Слайд 4
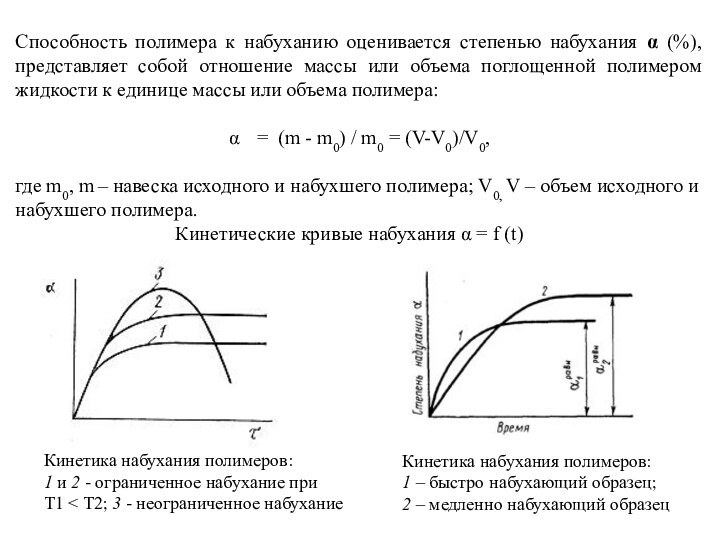
Способность полимера к набуханию оценивается степенью набухания
(%), представляет собой отношение массы или объема поглощенной полимером
жидкости к единице массы или объема полимера:
= (m - m0) / m0 = (V-V0)/V0,
где m0, m – навеска исходного и набухшего полимера; V0, V – объем исходного и набухшего полимера.
Кинетические кривые набухания = f (t)
Кинетика набухания полимеров:
1 и 2 - ограниченное набухание при
Т1 < Т2; 3 - неограниченное набухание
Кинетика набухания полимеров:
1 – быстро набухающий образец;
2 – медленно набухающий образец
Слайд 5
Факторы, определяющие набухание и растворение полимеров:
1) природа полимера
и растворителя (или его паров);
2) гибкость цепи полимера;
3) молекулярная масса полимера;
4) надмолекулярная структура полимера;
5) наличие поперечных химических связей в полимере;
6) температура системы.
Природа полимера и растворителя.
Линейные, слаборазветвленные неполярные полимеры (ПИБ, СКИ, СКД) хорошо набухают и растворяются в углеводородах (бензол, толуол, бензин); не растворяются в полярных органических растворителях (кетоны, спирты, вода).
Полярные полимеры (ПММА, ПАН, ПВС, ПА) хорошо растворяются в жидкостях близких к ним по полярности (амидные растворители, спирты, кетоны), не растворяются в углеводородах.
Слайд 6
С точки зрения термодинамики способность полимера к
самопроизвольному растворению (при постоянных Т и Р) определяется соотношением
ΔG = ΔU – TΔS
где ΔG – изменение свободной энергии Гиббса в системе полимер-растворитель, ΔU, ΔS – изменение внутренней энергии, энтропии системы.
Самопроизвольное растворение полимера происходит при уменьшении свободной энергии системы, т.е. ΔG < 0, при этом:
энтропия системы при самопроизвольных процессах, как правило, возрастает, поэтому TΔS увеличивается, что способствует растворению;
изменение ΔU зависит от энергии межмолекулярных взаимодействий полимер-растворитель, полимер-полимер и растворитель-растворитель.
Если взаимодействие полимер-растворитель полимер-полимер или растворитель-растворитель, то ΔU 0; способствует растворению;
Если взаимодействие полимер-растворитель полимер-полимер или растворитель-растворитель, то ΔU 0; наличие или отсутствие растворения зависит от соотношения ΔU и TΔS.
Слайд 7
Гибкость цепи полимера.
Полимеры с гибкими цепями легче

набухают, т.к. тепловое движение сегментов способствует проникновению молекул растворителя
в объем полимера (I стадия), а также легче диффундируют в растворитель, поскольку диффузия осуществляется путем последовательных перемещений сегментов макромолекул (II стадия).
Молекулярная масса полимера.
Чем выше ММ макромолекул (длиннее цепи), тем больше энергия взаимодействия между ними; тем больше требуется энергии для их разделения. В ряду полимергомологов способность к растворению в одном и том же растворителе снижается.
Надмолекулярная структура.
Кристаллические полимеры набухают и растворяются гораздо хуже, чем аморфные из-за достаточно сильного межмолекулярного взаимодействия и плотной упаковки макромолекул в кристаллической фазе.
Наличие поперечных связей в полимере.
Даже небольшое количество поперечных связей препятствует отделению макромолекул друг от друга и их диффузии в растворитель. Редко сшитые полимеры только набухают, а густо сшитые полностью теряют способность набухать.
Температура растворения.
Для большинства полимеров способность набухать и/или растворяться увеличивается с повышением температуры.
Слайд 8
Количественные характеристики термодинамического сродства полимера и растворителя:
1. Параметр
растворимости, δ, (МДж/м3)1/2
2. Свободная энергия смешения, ΔGсм
3. Изменение химического
потенциала растворителя, Δμ
4. Величина второго вириального коэффициента, А2, м3*моль/кг2
5. Параметр взаимодействия Флори-Хаггинса, χ
Параметр растворимости, δ (МДж/м3)1/2 – характеризует плотность энергии когезии (ПЭК), которая является мерой интенсивности межмолекулярного взаимодействия в веществе. ПЭК, МДж/м3 количественно определяется
где Еисп – энергия, необходимая для полного испарения вещества;
Vмол - молекулярный объем вещества.
Параметр растворимости δ (МДж/м3)1/2
δ = ПЭК = Еисп/Vмол
Слайд 9
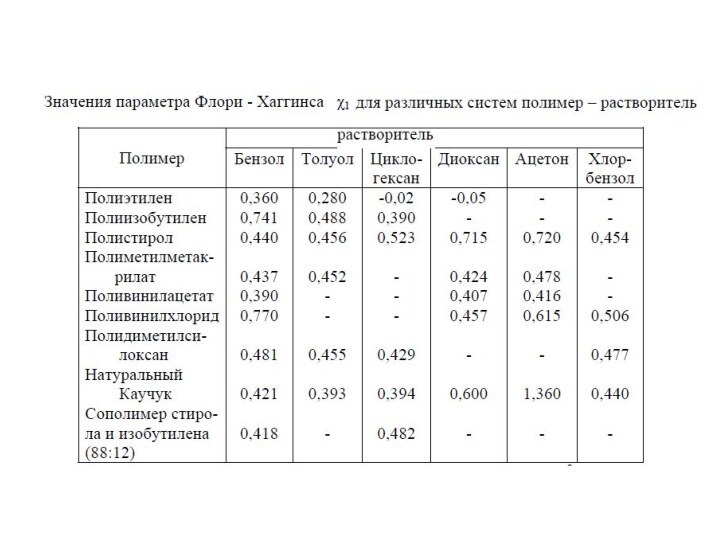
Параметры растворимости растворителей известны, сведены в справочники.
Параметры растворимости
полимеров определяются косвенно: δп = δж,
где δж –
параметр растворимости жидкости в котором степень набухания полимера максимальна.
Лучшим растворителем для данного полимера, как правило, является жидкость с близким значением параметра растворимости.
δ для ФФС; СКИ – 23,5; 18,8 (МДж/м3)1/2 соответственно. Растворитель ?
Слайд 10
Свободная энергия смешения Δ Gсм.
Самопроизвольное растворение полимера
(или взаимное смешение компонентов) при постоянных Т и Р
определяется условием:
раствор полимера должен обладать меньшей свободной энергией, чем сумма свободных энергий исходных компонентов (полимера и растворителя):
Gр-ра Gi0 ni
где Gр-ра - свободная энергия раствора полимера; Gi0 ni - сумма свободных энергий компонентов, где Gi0 – свободная энергия 1 моль i-го компонента, ni – количество молей.
Разность между этими величинами называют свободной энергией смешения:
Δ Gсм = Gр-ра - Gi0 ni
При самопроизвольном растворении свободная энергия смешения является величиной отрицательной Δ Gсм 0.
“Хорошие” растворители (высокое термодинамическое сродство) - большие отрицательные значения ΔGсм.
“Плохие” растворители – ΔGсм 0 или ΔGсм 0
Слайд 11
Изменение химического потенциала растворителя, Δ
О термодинамическом
сродстве полимера и растворителя можно также судить по изменению
химического потенциала i-го компонента (полимера или растворителя) в процессе растворения. Условие самопроизвольного растворения – существенное уменьшение i, т.е.
Δ i = i - i0
Δ i 0
где i0 – химический потенциал i-го компонента до растворения.
“Хорошие” растворители - при взаимодействии с полимером достигаются большие отрицательные значения Δ i.
“Плохие” растворители – Δ i 0 или Δ i 0
На практике экспериментально определяют изменение химического потенциала растворителя Δр :
измерением давления пара растворителя над раствором полимера;
измерением осмотического давления разбавленных растворов полимера.
Слайд 12
Давление пара над растворами полимеров.
Измеряемое над раствором

полимера давление пара является давлением пара растворителя, так как
полимер не переходит в парообразное состояние.
Изменение химического потенциала растворителя для реального раствора описывается уравнением:
Δ 1 = RT ln p1/p10,
где p1 и p10 – давление пара растворителя над раствором полимера и над чистым растворителем.
Если давление пара растворителя над раствором полимера меньше, чем над чистым растворителем p1 p10 , то это означает уменьшение числа молекул растворителя в паровой фазе и свидетельствует о хорошем взаимодействии между растворителем и полимером; ln p1/p10 0, Δ 1 0 растворение происходит самопроизвольно.
В противном случае p1 p10, то это значит, что молекулы растворителя стремятся перейти в парообразное состояние в большем количестве, чем в чистом растворителе и свидетельствует о слабом взаимодействии полимера и растворителя; ln p1/p10 0 и Δ 1 0 самопроизвольного растворения не происходит.
Слайд 13
Осмотическое давление растворов полимеров.
Если разделить раствор полимера в
хорошем растворителе (А) и чистый растворитель (Б) полупроницаемой перегородкой,
через которую могут диффундировать только молекулы растворителя, то вследствие неравенства химических потенциалов растворителя по обе стороны перегородки его молекулы начнут перемещаться в раствор, оказывая дополнительное гидростатическое давление на стенки ячейки А и перегородку. Это давление, называемое осмотическим . Дополнительное давление компенсируется поднятием жидкости в капилляре.
Т.о. стремление молекул растворителя к
самопроизвольному проникновению в раствор,
вызванное неравенством химических потенциалов
1 10 можно оценить величиной
осмотического давления
Чем выше осмотическое давление, тем выше термодинамическое сродство между компонентами, тем более хорошим является растворитель для данного полимера.
Слайд 14
В разбавленных растворах НМС осмотическое давление линейно зависит
от концентрации растворенного вещества (закон Вант-Гоффа):
=сRT,
где с
– концентрация растворенного вещества.
В разбавленных растворах полимеров осмотическое давление возрастает не пропорционально их концентрации, а значительно быстрее.
Поэтому используется уравнение Ван-дер-Ваальса в виде вириального разложения концентрации с по степеням:
= RT(А1с + А2с2 + А3с3 + …)
или /с = RT(А1 + А2с + А3с2 + …),
где с- концентрация полимера в растворе; А1, А2, А3 – первый, второй, третий вириальные коэффициенты, которые зависят от размеров, формы макромолекул.
Первый вириальный коэффициент связан с ММ: А1=1/М
Второй вириальный коэффициент зависит от термодинамического сродства полимера и растворителя.
Третий и последующий члены степенного ряда – мало влияют на . Тогда:
/с = RT /М + А2с
Слайд 15
Количественно величина второго вириального коэффициента может быть определена
графически при измерении осмотического давления серии разбавленных растворов полимеров
и построении зависимости /с=f(с) – прямая линия, наклон которой - второй вириальный коэффициент.
Для растворов одного и того же полимера в различных растворителях зависимость /с=f(с) выражается серией прямых, исходящих из одной точки; наклон прямых определяется значением второго вириального коэффициента А2.
если А2 0 – растворитель хороший,
если А2 0- растворитель плохой,
если А2 = 0 идеальный растворитель,
т.е. такой растворитель, который не влияет
на форму макромолекул.
Слайд 16
Параметр взаимодействия Флори-Хаггинса, χ
где А2 – значение
второго вириального коэффициента, найденное графически;
ρ1,М1 – плотность и молекулярная
масса растворителя, ρ2 – плотность полимера
Термодинамическое сродство наблюдается при χ < ½
Параметр Флори-Хаггинса χ - безразмерный параметр, является мерой термодинамического сродства полимера и растворителя.
Параметр χ рассчитывают из экспериментальных данных по понижению давления пара над растворами полимеров либо по осмотическому давлению растворов полимеров. В последнем случае параметр Флори - Хаггинса связан с А2 соотношением
А2 = ρ1/М1 ρ22 (1/2 – χ),
Слайд 18
Конформации макромолекул в растворе зависят от природы растворителя.
В
термодинамически хорошем растворителе, где А2 > 0, χ
½
макромолекулы имеют конформацию очень рыхлого клубка (а);
в идеальном растворителе, где А2 = 0, χ = ½ - статистического клубка (б);
в термодинамически плохом растворителе, где А2 < 0, χ > ½ - плотной глобулы (в).
Слайд 19
Пластификация полимеров.
Пластификация полимеров - введение низкомолекулярных веществ
(пластификаторов), облегчающих переработку материала и придающих ему морозостойкость. Введение
пластификаторов увеличивает гибкость макромолекул и подвижность надмолекулярных структур.
Количественно пластификация оценивается снижением Тс и Тт полимеров, при этом:
снижение Тс полимеров означает повышение морозостойкости, т.е. улучшение эксплуатационных свойств;
снижение Тт означает улучшение технологических свойств, повышение безопасности переработки, т.к. у некоторых полимеров Тт близка к температуре разложения.
При введении в полимер пластификатора закономерно понижаются и Тс и Тт. Однако при введении больших количеств пластификатора, более 30 % (объемн.) Тт снижается сильнее, что приводит к сужению интервала Тт – Тс, и, соответственно, к сужению температурного интервала высокоэластичности.
Слайд 20
По агрегатному состоянию пластификаторы:
высококипящие, малолетучие жидкости;
твердые вещества с

невысокой температурой размягчения, которые в процессе переработки находится в
размягченном состоянии.
При наличии т/д сродства между полимером и пластификатором происходит молекулярное диспергирование, т.е. полимер самопроизвольно набухает в пластификаторе, неограниченно совместим с полимером.
Если пластификатор не имеет сродства к полимеру, то самопроизвольно не проникает в полимер, но может быть коллоидно диспергирован с затратой механической энергии.
Для оценки термодинамического сродства между полимером и пластификатором следует рассчитать величину Δ 1 (изменения химического потенциала пластификатора). Для этого необходимо измерить давление пара пластификатора над системой полимер-пластификатор. В соответствии с этим пластификаторы делятся на пластификаторы-растворители (в которых данный полимер неограниченно растворяется) и пластификаторы нерастворители (в которых полимер ограниченно набухает).
Слайд 21
Механизм пластификации.
Различают:
внутрипачечную (внутриструктурную)
межпачечную (межструктурную) пластификацию.
Внутрипачечная пластификация
сопровождается молекулярным смешением компонентов, при этом происходит резкое уменьшение
вязкости полимера и увеличение гибкости его цепей. Основное условие внутрипачечной пластификации высокая т/д совместимость полимера и пластификатора.
Межпачечная пластификация наблюдается при использовании пластификатора, который не совместим или ограниченно совместим с полимером. В случае межпачечной пластификации молекулы пластификатора располагаются на поверхности надмолекулярных структур, создавая поверхностную смазку и увеличивая тем самым подвижность структур. При этом количество вводимого пластификатора составляет доли процента.
Слайд 22
Теории пластификации.
Попытки теоретически обосновать механизм внутрипачечной пластификации
предпринимались Журковым, Каргиным и Малинским.
В случае полярного полимера
пластифицирующее действие полярного пластификатора заключается в сольватации полярных групп полимера молекулами пластификатора, при этом снижается межмолекулярное взаимодействие и температура стеклования. Понижение температуры стеклования пропорционально числу молей введенного пластификатора:
Δ Тс = К*м,
где К – коэффициент пропорциональности, м – число молей пластификатора.
Эта зависимость была установлена Журковым, поэтому – правило Журкова или правило мольных долей. Это правило соблюдается только для полярных полимеров.
Слайд 23
В случае неполярных и малополярных полимеров пластификация заключается
не в экранировании функциональных групп, а в увеличении свободного
объема в полимере, что ведет к увеличению конформационных превращений полимерных цепей и снижению температуры стеклования.
Понижение температуры стеклования пропорционально объемной доле пластификатора (правило Каргина-Малинского):
Δ Тс = К*,
- объемная доля пластификатора.
Понижение температуры стеклования в этом случае зависит от размера и формы молекул пластификатора. Правило справедливо только для ряда неполярных или малополярных полимеров.
Слайд 24
Результаты пластификации иллюстрируются с помощью термомеханических кривых
Термомеханические кривые
для непластифицированного (1) и пластифицированного полимеров (2, 3):
а
– аморфный полимер; б – кристаллизующийся полимер со степенью
кристалличности 1 (2) и 2 (3), при этом 1 > 2.