Слайд 2
Самостоятельная работа
Вариант 1
Что такое индекс загрязнения воздуха? Как

он рассчитывается?
Чему равен объем пробы газа, приведенный к нормальным
условиям, если при температуре 31С и давлении 0,5 атм объем составляет 45 литров?
Каково содержание частиц сажи в атмосферном воздухе, если отбор пробы производили в течение суток при температуре 26С и давлении 761 мм рт ст со скоростью 1,4 л/мин через бумажный фильтр. После измерения адсорбции установлено, что масса сажи составляет 15 мкг на 1 см2 и площадь фильтра 5 см2.
Вариант 2
На какие группы делятся все загрязнители атмосферного воздуха и их характеристики? Что входит в каждую группу?
Чему равен объем пробы газа, при температуре 20С и давлении 99 кПа, если объем приведенный к нормальным условиям составляет 45 литров?
Каково содержание диоксида серы в атмосферном воздухе, если отбор пробы производили в течение 60 минут при температуре 18С и давлении 769 мм рт ст со скоростью 1 л/мин через абсорбер. Затем поглотительный раствор переносят в мерную колбу объемом 25 мл, добавляют необходимые реактивы и после измерения абсорбционности установлено, что масса диоксида серы составляет 2,5 мкг на 1 см3 поглотительного раствора.
Слайд 3
Загрязнение атмосферного воздуха оксидами азота и методы их
определения
Слайд 4
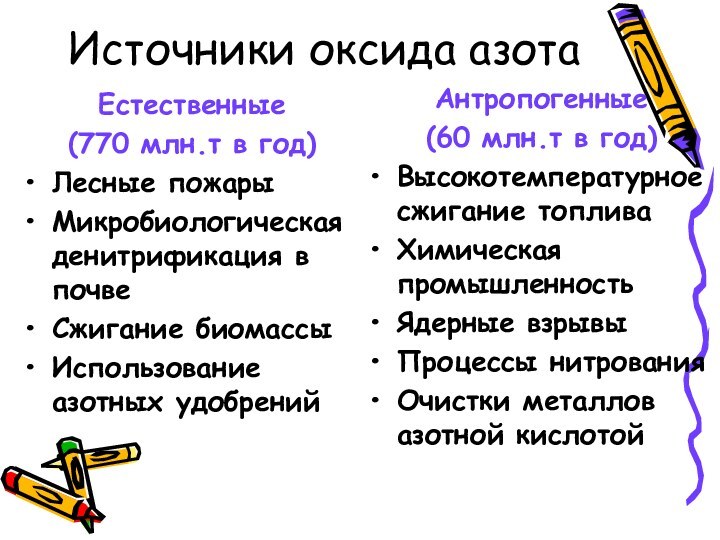
Источники оксида азота
Естественные
(770 млн.т в год)
Лесные пожары
Микробиологическая
денитрификация в почве
Сжигание биомассы
Использование азотных удобрений
Антропогенные
(60 млн.т в
год)
Высокотемпературное сжигание топлива
Химическая промышленность
Ядерные взрывы
Процессы нитрования
Очистки металлов азотной кислотой
Слайд 5
При высокотемпературном сгорании ископаемых видов топлива происходят реакции
двух типов, в результате которых образуются оксиды азота.
К первому
типу реакций относятся реакции между кислородом воздуха и азотом, содержащемся в этом топливе; при этом образуются оксиды азота. В угле содержание азота обычно составляет около 1%, в нефти и газе – 0,2-0,3% и именно этот азот окисляется кислородом воздуха.
Ко второму типу реакций относятся реакции между кислородом и азотом воздуха, при этом также образуются оксиды азота.
Слайд 6
Приблизительно 95% годового выброса оксидов азота в атмосферу
– это результат сжигания ископаемого топлива. Из них 40%
- автомобильное топливо, 30% - природный газ, нефть, уголь на электростанциях, 29% - сжигание топлива для различных технологических процессов. Примерно 90% оксидов азота образуется в форме оксида азота (II). Оставшиеся 10% приходится на оксид азота (IV). Однако, в ходе сложной последовательности химических реакций в воздухе значительная часть NO превращается в NO2 – гораздо более опасное соединение.
Слайд 7
Поведение и реакции в атмосфере
2NO+O2→2NO2
NO+O3→NO2+O2
NO2→(СВЕТ)NO+O
2NO2+Na2CO3→NaNO2+NaNO3+CO2
4NO2+2CaCO3→Ca(NO2)2+Ca(NO3)2+2CO2
2NO2+H2O→HNO2+HNO3
2N2O →(СВЕТ)2NO+N2
HNO3+NH3→NH4NO3
Слайд 8
Химические превращения оксидов азота в атмосфере
Сжигание
топлива
Производство
азотной
кислоты,
взрыв.веществ
Микробиологические
процессы в почве
NO
N20
NH4NO3
NH3
NO2
HNO2
HNO3
Карбонаты
щелочных
и щелочно-
земельных
металлов
Нитраты
щелочных
и щелочно-
земельных
металлов
Солнечный свет
+
Слайд 9
Воздействие оксидов азота на человека
Оксид азота (IV) –
газ с неприятным запахом. Даже при малых концентрациях, составляющих
всего 230 мкг/м3 ощущается его присутствие. После 10 минут способность обнаруживать этот газ исчезает, остается чувство сухости и “першения” в горле. И эти ощущения исчезают при продолжительном воздействии газа в концентрации в 15 раз превышающей порог обнаружения (230 мкг/м3). Она ослабляет ночное зрение – способность глаз адаптироваться к темноте. Этот эффект наблюдается при концентрациях всего 0,14 мг/м3. Здоровые люди при концентрациях NO2 всего 0,056 мг/м3, а люди с хроническими заболеваниями легких при 0,038 мг/м3 испытывают затрудненность в дыхании.
NO2 является причиной многих легочных заболеваний: катар верхних дыхательных путей, бронхита, крупа, воспаления легких и др.
Слайд 10
Действие оксидов азота на растения
Прямое воздействие NOx на
растения определяется визуально по пожелтению или побурению листьев и
игл, происходящему в результате окисления хлорофилла. Окисление жирных кислот в растениях, происходящее одновременно с окислением хлорофилла, кроме того, приводит к разрушению мембран и некрозу. Образующаяся при этом в клетках азотистая кислота оказывает мутагенное действие. Отрицательное биологическое воздействие NOx на растения проявляется в обесцвечивании листьев, увядании цветков, прекращении плодоношения и роста. Такое действие объясняется образованием кислот при растворении оксидов азота в межклеточной и внутриклеточной жидкостях. Нарушения роста растений при воздействии NO2 наблюдаются при концентрациях 0,35 мг/м3 и выше. Это значение является предельной концентрацией. Опасность повреждения растительности диоксидом азота существует только в больших городах и промышленных районах, где средняя концентрация NO2 составляет 0,2 – 0,3 мг/м3.
Слайд 11
Экологические стандарты на содержание оксидов азота
NO2:
Максимальная разовая
ПДК 0,085 мг/м3
Среднесуточная ПДК 0,040 мг/м3
NO:
Максимальная разовая ПДК
0,400 мг/м3
Среднесуточная ПДК 0,060 мг/м3
Слайд 12
Методы определения оксидов азота в атмосферном воздухе
Слайд 13
Спектрофотометрический метод
Международный стандарт
ИСО 6768 устанавливает модифицированный метод
Грисса-Зальцмана
для определения массового содержания диоксида азота в окружающем
воздухе
Слайд 14
Данный метод применим для определения содержания NO2 вне
и внутри помещений при его содержании от 0,003 до
примерно 2 мг/м3. Продолжительность отбора проб может составлять от 10 минут до 2 часов.
Слайд 15
Сущность метода заключается в поглощении диоксида азота раст-вором
азокрасителя (сульфа-ниловая кислота) с образованием розовой окраски. Интенсивность которой
определяют спектро-фотометрически, а концентрацию диоксида азота находят по калибровочному графику.
Слайд 16
При определении концентрации NO и NO2 из одной
пробы исследуемый воздух аспирируют в течение 20 минут со
скоростью 0,25 л/мин через систему изображенную на рисунке
Слайд 18
При отборе пробы в барботеры воздух аспирируют через
систему, состоящую из двух последовательно соединенных поглотительных приборов с
пористой пластинкой, содержащих по 6 мл 8%-ного раствора KI и расположенной между ними стеклянной трубки. Трубка заполняется 15 см3 стабилизатором влажности (гранулированная уксусная кислота) и 10 см3 окислителя (оксида хрома VI), разделенными тампоном из стекловаты. Первый поглотительный прибор служит для поглощения NO2 из воздуха, а второй для поглощения NO2 образовавшегося в результате окисления NO
Слайд 19
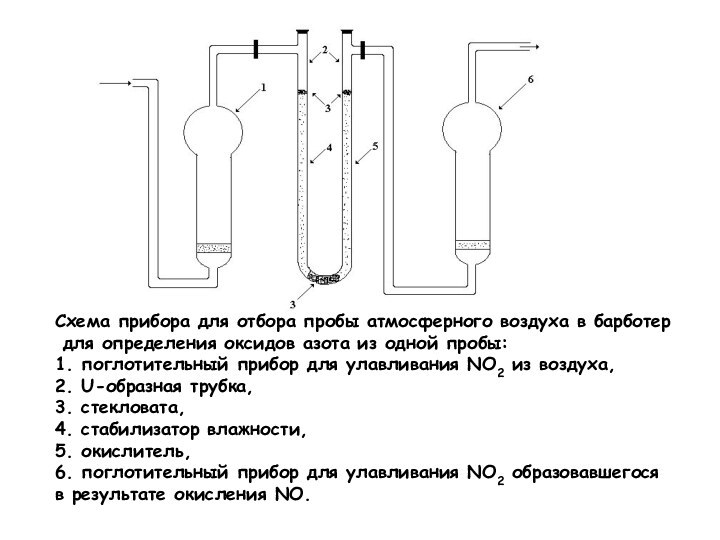
Схема прибора для отбора пробы атмосферного воздуха в
барботер
для определения оксидов азота из одной пробы:
1.
поглотительный прибор для улавливания NO2 из воздуха,
2. U-образная трубка,
3. стекловата,
4. стабилизатор влажности,
5. окислитель,
6. поглотительный прибор для улавливания NO2 образовавшегося
в результате окисления NO.
Слайд 20
Хемилюминесцентный метод определения
Международный стандарт
ИСО 7996 устанавливает хемилюминесцентный
метод
для определения массового содержания оксидов азота в окружающем воздухе
Слайд 21
Метод применим для определения содержания NO при его
содержании до 12,5 мг/м3, а NO2 при ее содержании
до 19 мг/м3 при 25С и 101,3 кПа
Слайд 22
Сущность метода заключается в определении оксида азота (диоксид
азота перед определением восстанавливается в оксид азота) при хемилюминесценции
пробы после ее обработки озоном:
NO+O3→ NO2*+O2; NO2*→NO2+h
Интенсивность выделяемого света пропорциональна концент-рации оксида азота в пробе воздуха.
Слайд 23
Определения с помощью индикаторных трубок
Международный стандарт
ИСО 8761
устанавливает метод
определения массового содержания диоксидов азота, присутствующего в воздухе
рабочих мест, непосредственным измерением с помощью индикаторных трубок
Слайд 24
Сущность метода заключается в образовании цветной реакции диоксида
азота, присутствующего в пробе воздуха, при его прохождении через
индикаторную трубку с реагентами на твердом носителе. Данный стандарт рекомендует применять трубки на основе следующих цветных реакций:
Слайд 25
Реакции с использованием N1N’-дифенилбинзидина
NO2+C6H5-NH-C6H4-NH-C6H5→окрашенные соединения
Окраска изменяется от серого
до серо-голубого в зависимости от концентрации газа. Хлор и
озон могут мешать определению, образуя сходное окрашивание
Слайд 26
Реакции с использованием
N-(1-нафтил)-этилендиаминдихлорида
NO2+C10H7-NH-CH2-CH2-NH22HCl → ди-азокомплекс
Окраска изменяется от
белого до красного. Помехи при определении могут создавать хлор
и озон.
Слайд 27
Реакции с использованием о-толуидина
NO2+NH2(CH3)C6H3-C6H3(CH3)NH2→ окрашенные соединения
Интенсивность окрашивания меняется
от белого до желто-оранжевого. Помехи из-за сходного окрашивания вызывают
гало-гены, диоксид хлора и другие окислители, диоксид серы при концентрации более 100 мг/м3 обесцвечивает окрашивание, образо- ванное диоксидом азота.