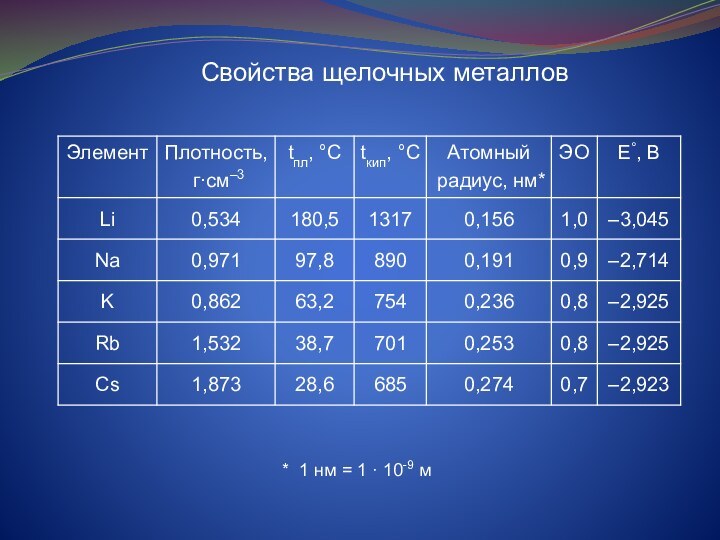
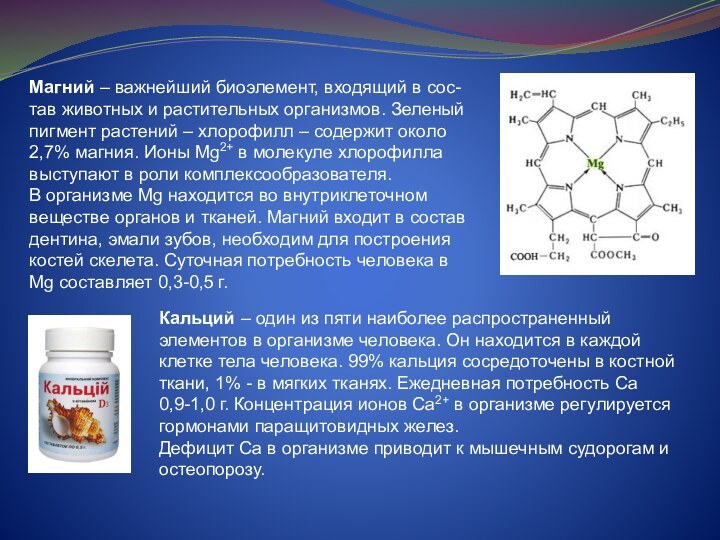
и растительных организмов. Зеленый пигмент растений – хлорофилл –
содержит около 2,7% магния. Ионы Mg2+ в молекуле хлорофилла выступают в роли комплексообразователя.
В организме Mg находится во внутриклеточном веществе органов и тканей. Магний входит в состав дентина, эмали зубов, необходим для построения костей скелета. Суточная потребность человека в Mg составляет 0,3-0,5 г.
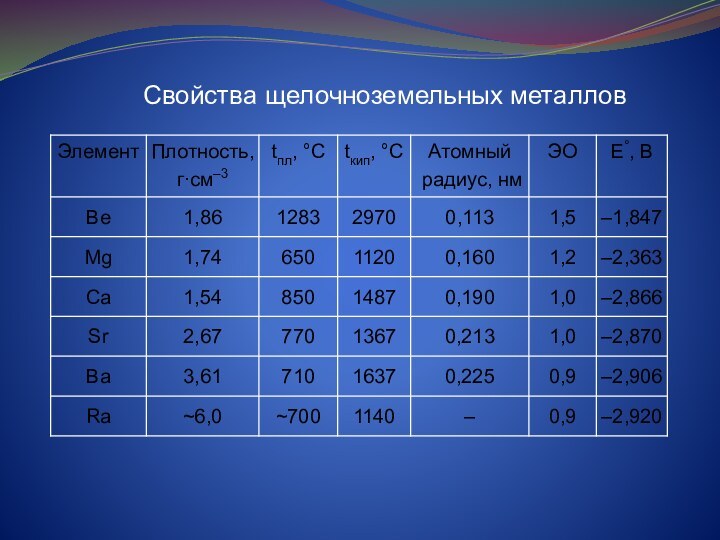
Кальций – один из пяти наиболее распространенный элементов в организме человека. Он находится в каждой клетке тела человека. 99% кальция сосредоточены в костной ткани, 1% - в мягких тканях. Ежедневная потребность Ca 0,9-1,0 г. Концентрация ионов Ca2+ в организме регулируется гормонами паращитовидных желез.
Дефицит Са в организме приводит к мышечным судорогам и остеопорозу.