Слайд 2
Спирты
Гидроксисоединения – это вещества, которые в своем составе
содержат –OH группы. К ним относят спирты, фенолы, нафтолы
и др. вещества.
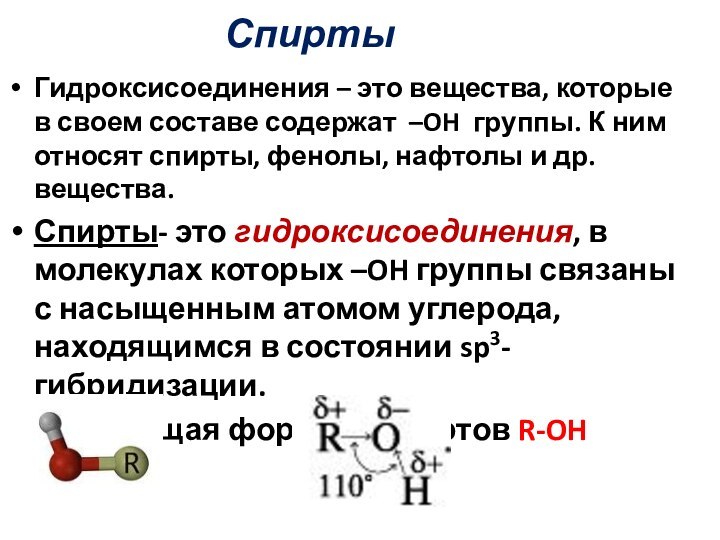
Спирты- это гидроксисоединения, в молекулах которых –OH группы связаны с насыщенным атомом углерода, находящимся в состоянии sp3-гибридизации.
Общая формула спиртов R-OH
Слайд 3
Классификация:
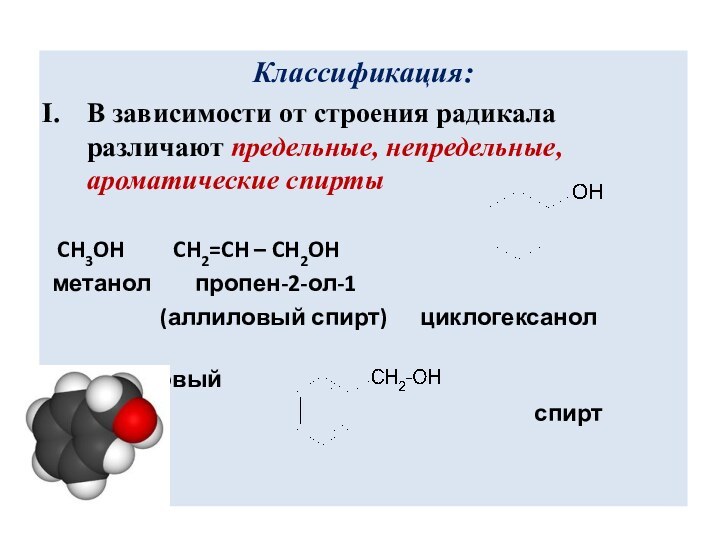
В зависимости от строения радикала различают предельные, непредельные,
ароматические спирты
CH3OH CH2=CH –
CH2OH
метанол пропен-2-ол-1
(аллиловый спирт) циклогексанол
бензиловый
спирт
Слайд 4
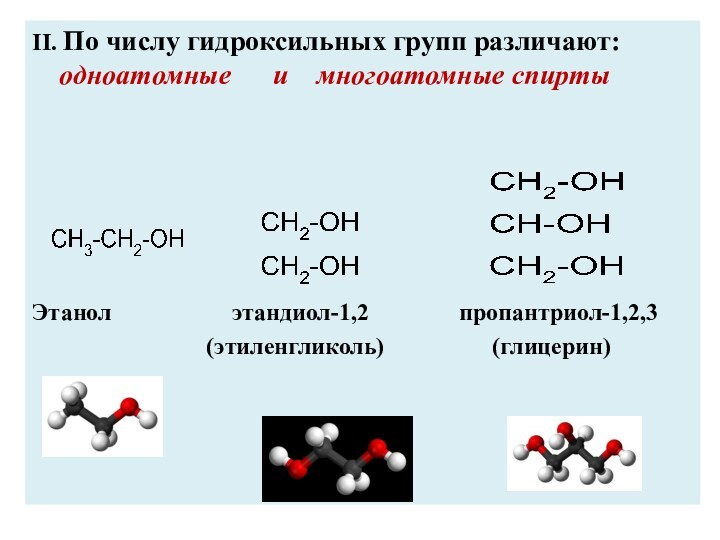
II. По числу гидроксильных групп различают: одноатомные
и многоатомные спирты
Этанол
этандиол-1,2 пропантриол-1,2,3
(этиленгликоль) (глицерин)
Слайд 5
OH
OH
OH
OH
HO
HO
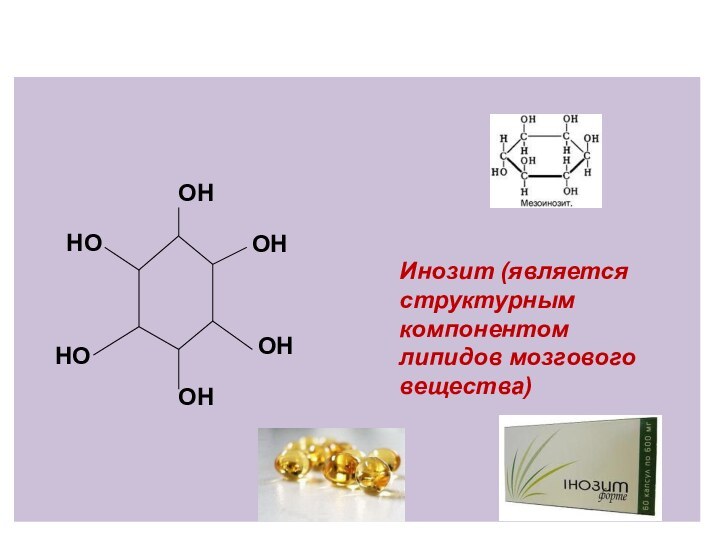
Инозит (является структурным
компонентом липидов мозгового вещества)
Слайд 6
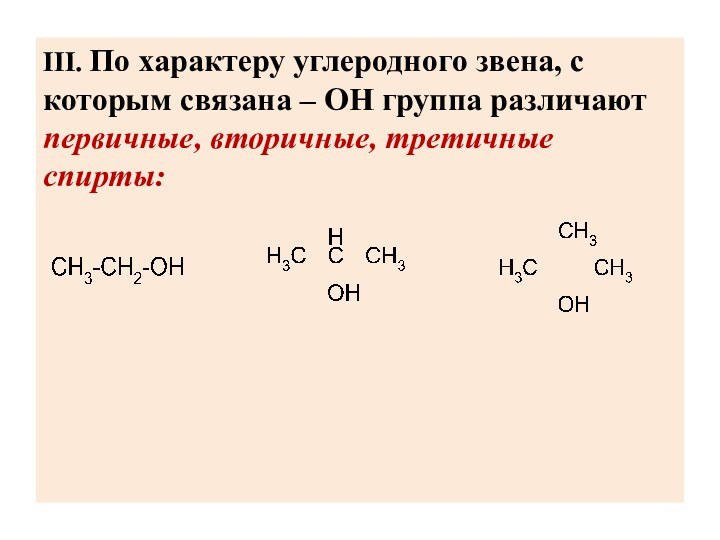
III. По характеру углеродного звена, с которым связана
– ОН группа различают первичные, вторичные, третичные спирты:
Слайд 7
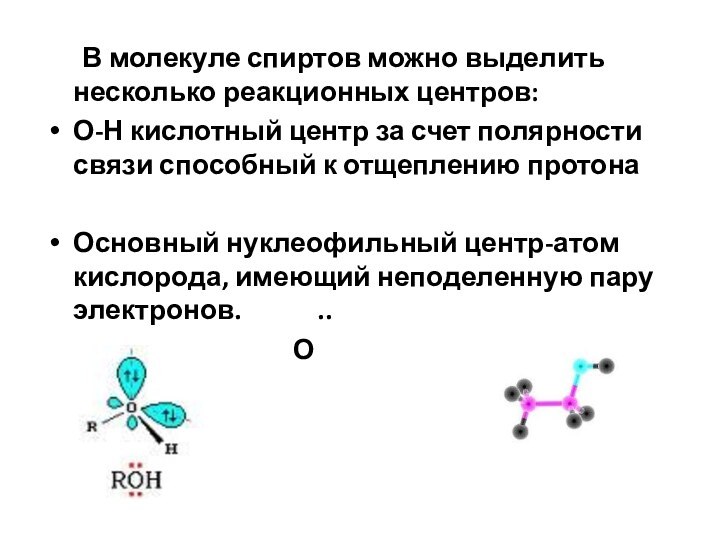
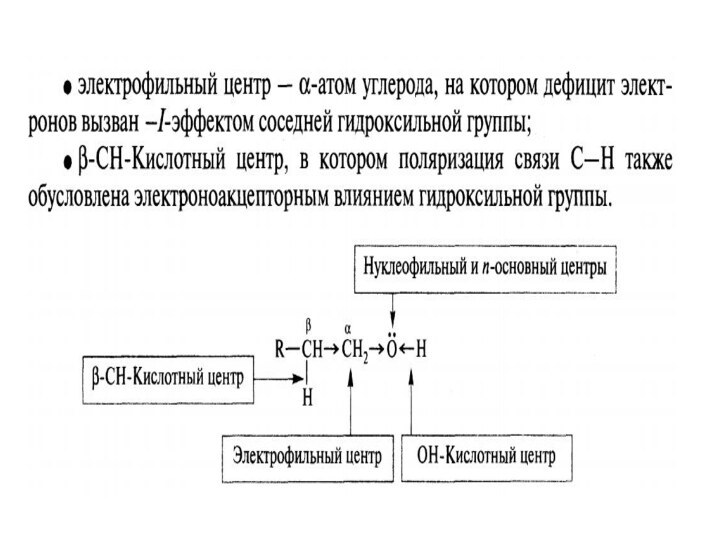
В молекуле спиртов можно выделить несколько реакционных центров:
О-Н
кислотный центр за счет полярности связи способный к отщеплению
протона
Основный нуклеофильный центр-атом кислорода, имеющий неподеленную пару электронов. ..
О
Слайд 9
Химические свойства спиртов
I. Реакции окисления
Внутри организма (in vivo)
эти реакции протекают с участием ферментов дегидрогеназ
Кофермент дегидрогеназы -
НАД+ (никотинамиддинуклеотид окисленный) служит акцептором гидрид-иона (Н-) при биологическом дегидрировании субстрата.
НАД+ превращается при этом в восстановленную форму фермента-НАДН.
Слайд 10
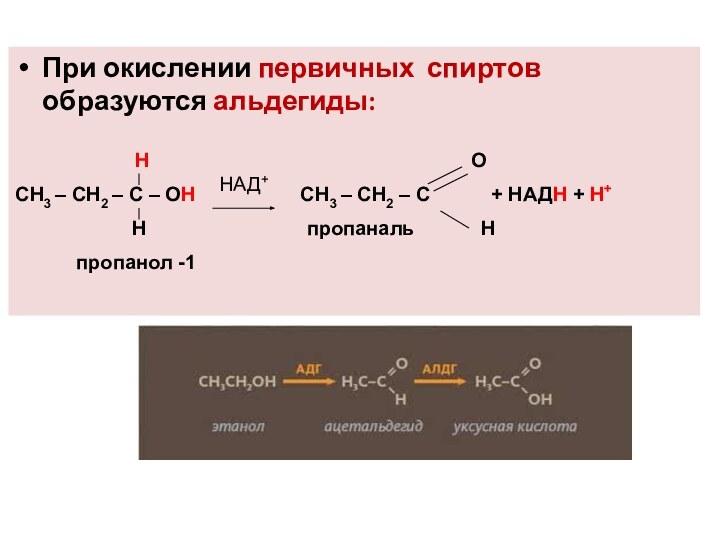
При окислении первичных спиртов образуются альдегиды:
Н О
СН3 – СН2 – С – ОН СН3 – СН2 – С + НАДН + Н+
Н пропаналь Н
пропанол -1
НАД+
Слайд 11
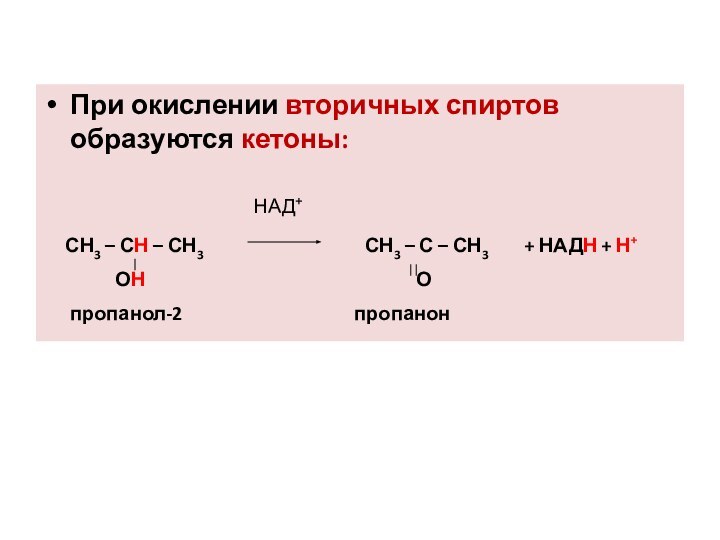
При окислении вторичных спиртов образуются кетоны:
СН3 – СН – СН3
СН3 – С – СН3 + НАДН + Н+
ОН О
пропанол-2 пропанон
НАД+
Слайд 12
2. Спирты проявляют слабые кислотные и слабые основные
свойства, то есть являются амфолитами.
Спирты как кислоты реагируют со
щелочными металлами, образуя алкоголяты, которые в растворах гидролизуются:
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
CH3CH2ONa + H2O → CH3CH2OH + NaOH
По кислотным свойствам спирты уступают воде.
Слайд 13
Основные свойства спиртов обусловлены наличием на атоме кислорода
гидроксильной группы неподеленной пары электронов, способной присоединять протон.
R-ОН + Н+ → R- О+ ̶ Н катион
¨ l оксония
Н
Слайд 14
3. Реакция нуклеофильного замещения (SN)
Реакции SN гидроксильной
группы протекают по месту гетеролитического разрыва полярной связи С-ОН.
Поскольку
ОН-группа является плохо уходящей группой, то прямое нуклеофильное замещение на галоген невозможно.
Поэтому ОН-группу в присутствии кислотного катализатора-ионов Н+ -переводят в оксониевую группировку, с образованием промежуточного иона алкилоксония.
Слайд 15
Тем самым плохоуходящая группа –ОН превращается в легкоуходящую
группу атомов, которая затем отделяется в виде молекулы воды
(нуклеофуг).
Реагент – нуклеофил (Сl- )присодиняется к атому углерода, образуя продукт.
Слайд 16
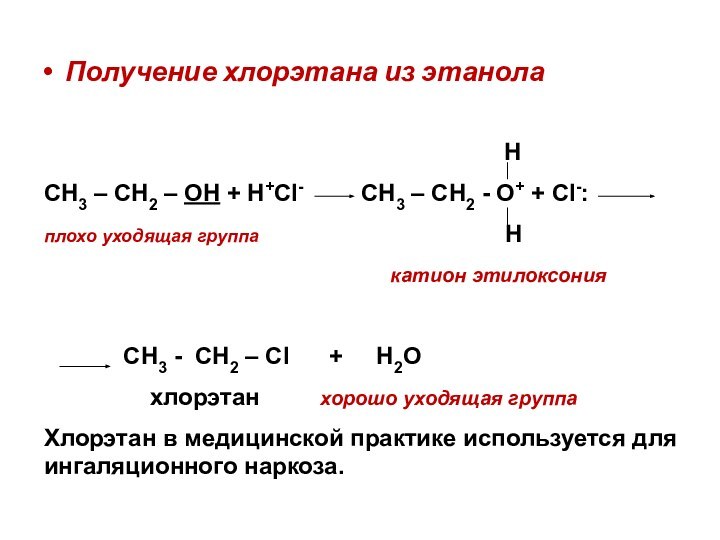
Получение хлорэтана из этанола
Н
СН3 – СН2 – ОН + Н+Cl- CН3 – СН2 - О+ + Cl-:
плохо уходящая группа Н
катион этилоксония
СН3 - СН2 – Сl + Н2О
хлорэтан хорошо уходящая группа
Хлорэтан в медицинской практике используется для ингаляционного наркоза.
Слайд 17
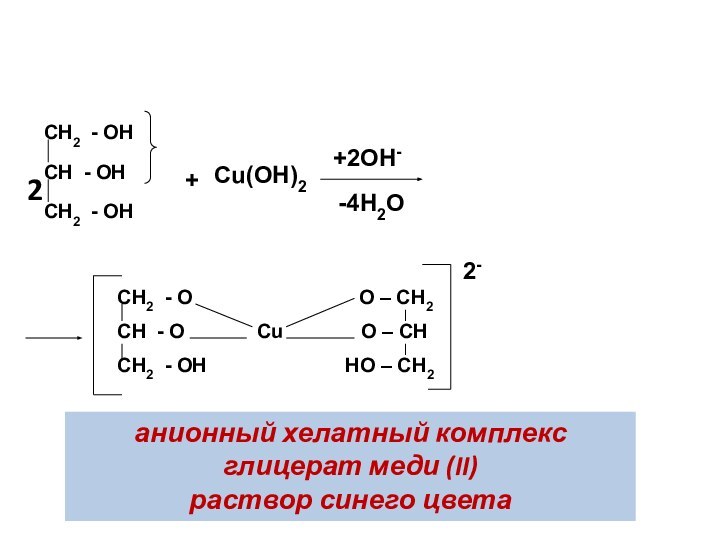
4. Реакция хелатообразования
Многоатомные спирты, проявляют более выраженные кислотные
свойства по сравнению с одноатомными спиртами
При взаимодействии с Сu(ОН)2
в щелочной среде образуют растворимый хелатный комплекс ярко синего цвета.
Данная реакция используется для качественного обнаружения многоатомных спиртов. В реакцию при этом вступает α-диольный фрагмент структуры (две –ОН группы в соседних звеньях).
Слайд 18
CH2 - OH
CH - OH
CH2 - OH
Cu(ОН)2
+2ОН-
-4Н2О
CH2 -
O
О – СН2
CH - O Cu О – СН
CH2 - OH НО – СН2
2-
+
2
анионный хелатный комплекс глицерат меди (II)
раствор синего цвета
Слайд 19
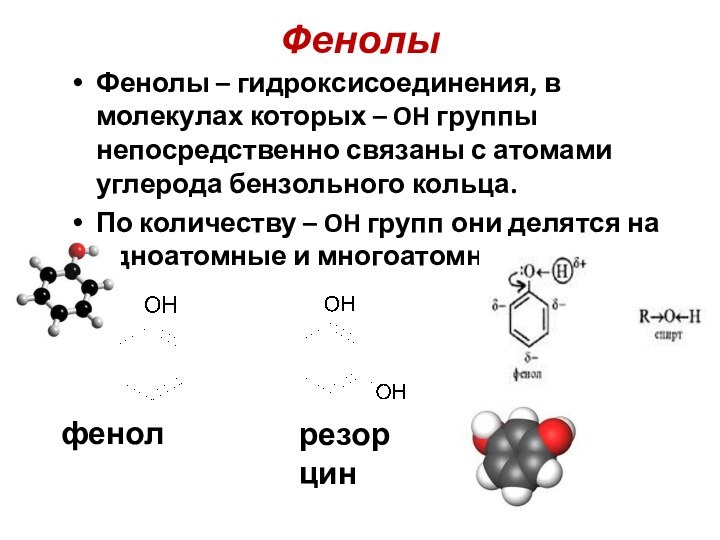
Фенолы
Фенолы – гидроксисоединения, в молекулах которых – OH
группы непосредственно связаны с атомами углерода бензольного кольца.
По
количеству – OH групп они делятся на одноатомные и многоатомные.
фенол
резорцин
Слайд 20
Фенол(раствор-карболовая кислота)
применяется в медицине как антисептическое средство,
используется для приготовления лекарственных веществ, красителей и др.
Резорцин(1,3дигидроксибензол)
применяется в
виде водных и спиртовых растворов для лечения кожных и инфекционных заболеваний. Смесь насыщенного резорцина и формалина (40% раствор) применяется в стоматологии для пломбирования корневых зубных каналов.
Слайд 21
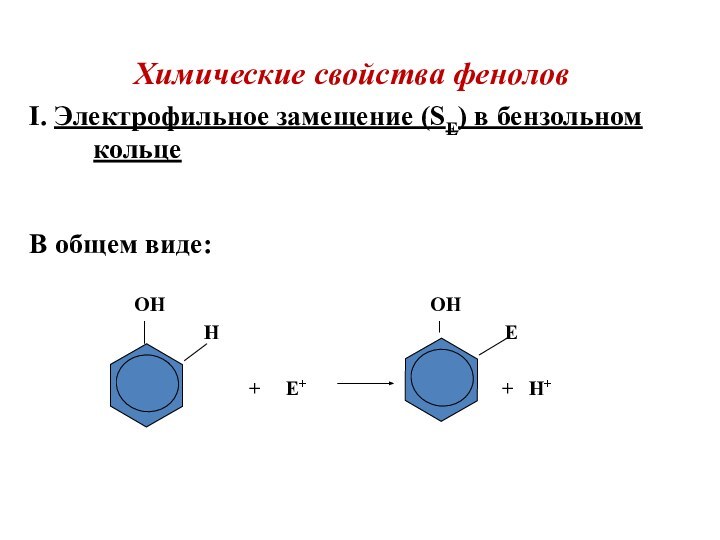
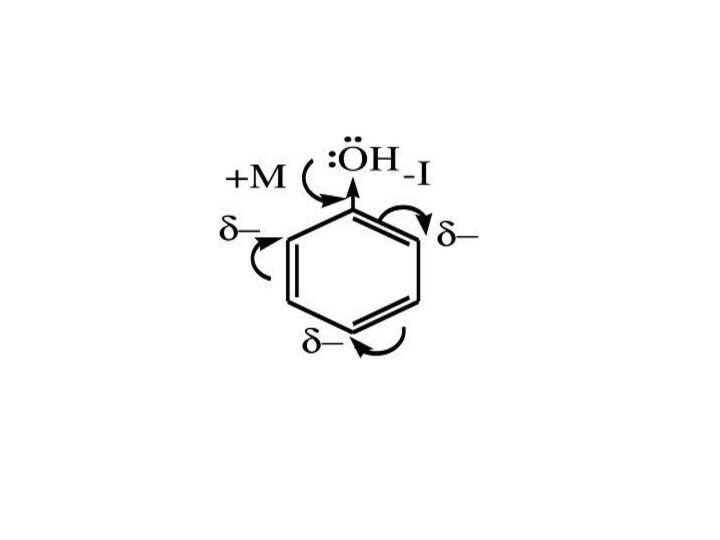
Химические свойства фенолов
I. Электрофильное замещение (SЕ) в бензольном
кольце
В общем виде:
OH OH
H E
+ E+ + H+
Слайд 23
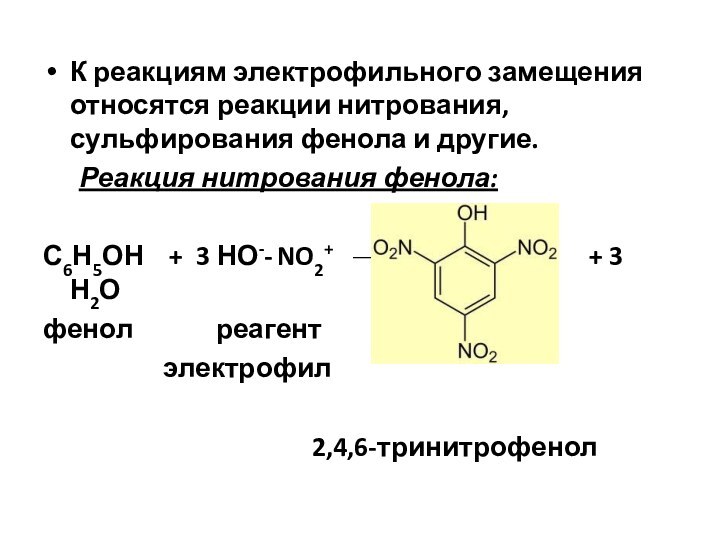
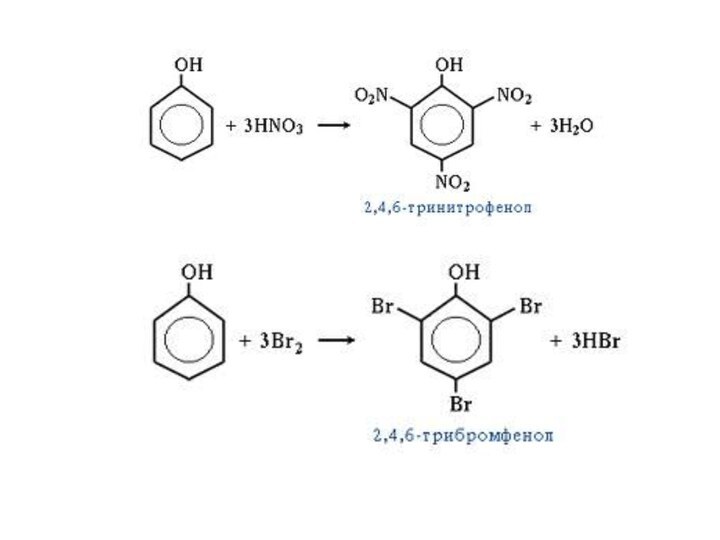
К реакциям электрофильного замещения относятся реакции нитрования, сульфирования
фенола и другие.
Реакция нитрования фенола:
С6Н5ОН + 3 НО-- NO2+ + 3 Н2О
фенол реагент
электрофил
2,4,6-тринитрофенол
Слайд 25
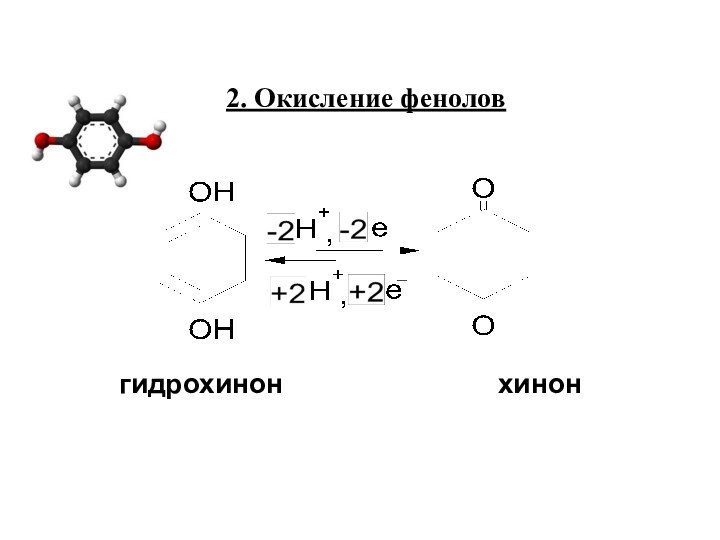
2. Окисление фенолов
гидрохинон
хинон
Слайд 26
Система хинон-гидрохинон in vivo участвует в переносе электронов
от субстрата к кислороду через систему цитохромов.
Хиноны широко распространены
в природе и играют роль стимуляторов роста, антибиотиков.
Слайд 27
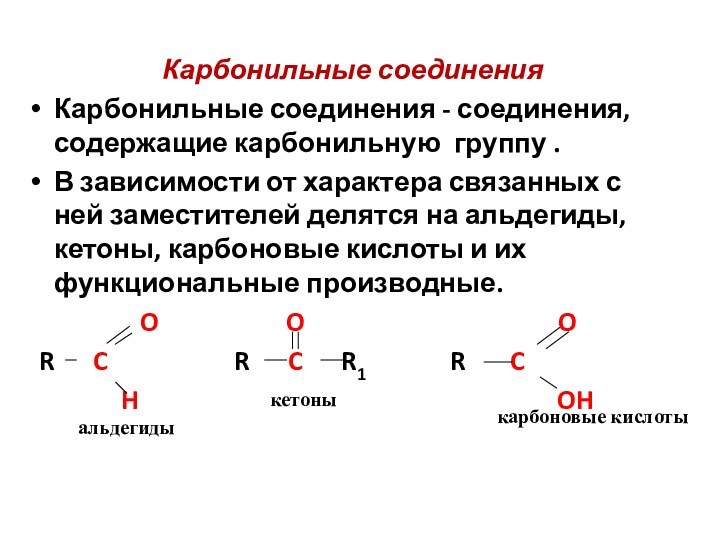
Карбонильные соединения
Карбонильные соединения - соединения,
содержащие карбонильную группу .
В зависимости от характера связанных
с ней заместителей делятся на альдегиды, кетоны, карбоновые кислоты и их функциональные производные.
O O O
R C R C R1 R C
H OH
альдегиды
кетоны
карбоновые кислоты
Слайд 28
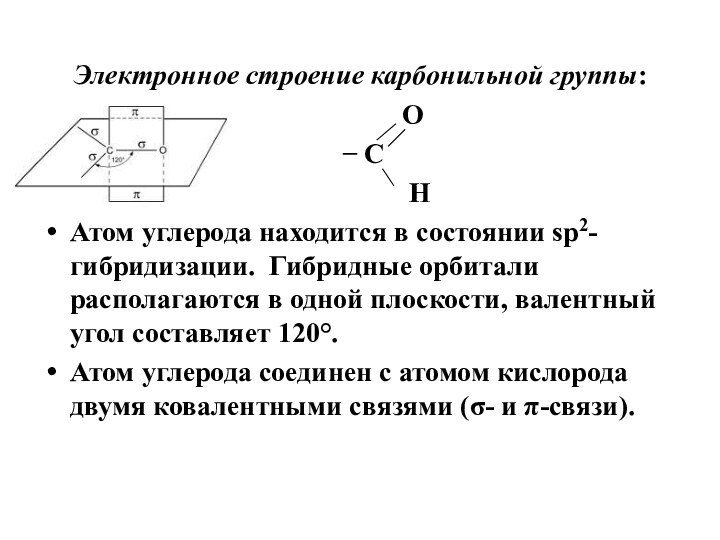
Электронное строение карбонильной группы:
О
̶ С
Н
Атом углерода находится в состоянии sp2-гибридизации. Гибридные орбитали располагаются в одной плоскости, валентный угол составляет 120°.
Атом углерода соединен с атомом кислорода двумя ковалентными связями (σ- и π-связи).
Слайд 29
π-связь сильно поляризована, её электронная плотность смещена к
более электроотрицательному атому кислороду, на котором возникает частичный отрицательный
заряд.
На атоме углерода при этом наблюдается недостаток электронной плотности.
Слайд 30
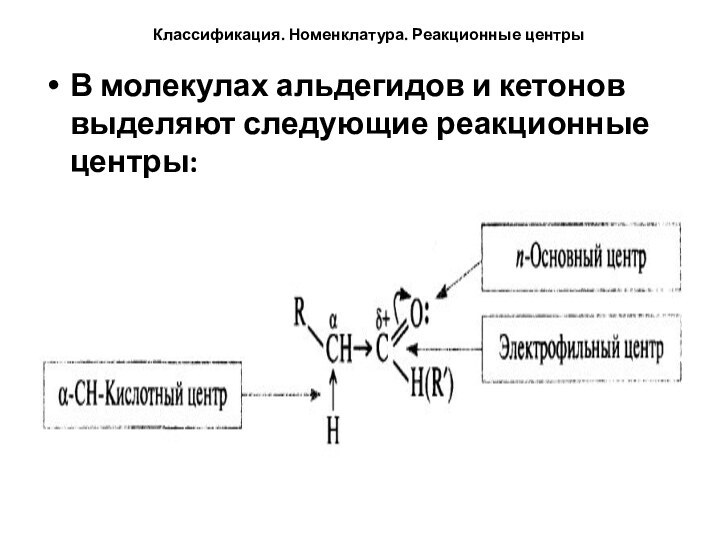
Классификация. Номенклатура. Реакционные центры
В молекулах альдегидов и кетонов
выделяют следующие реакционные центры:
Слайд 31
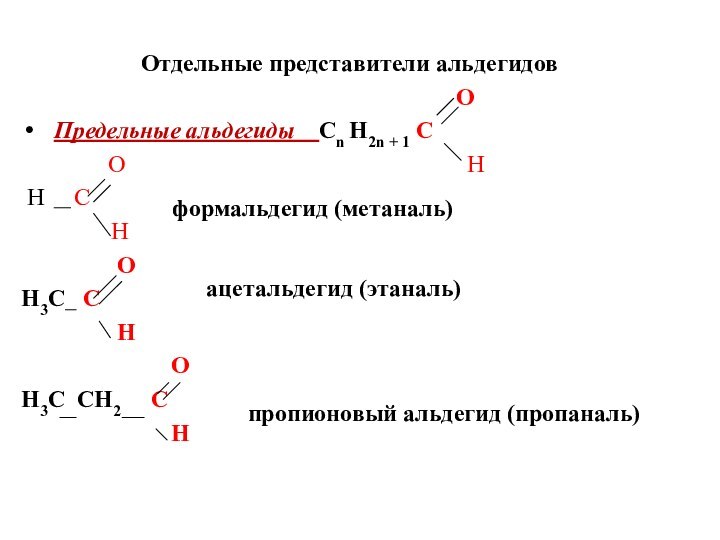
Отдельные представители альдегидов
O
Предельные альдегиды Cn Н2n + 1 C
O H
H C
H
O
H3C C
H
O
H3C CH2 C
H
формальдегид (метаналь)
ацетальдегид (этаналь)
пропионовый альдегид (пропаналь)
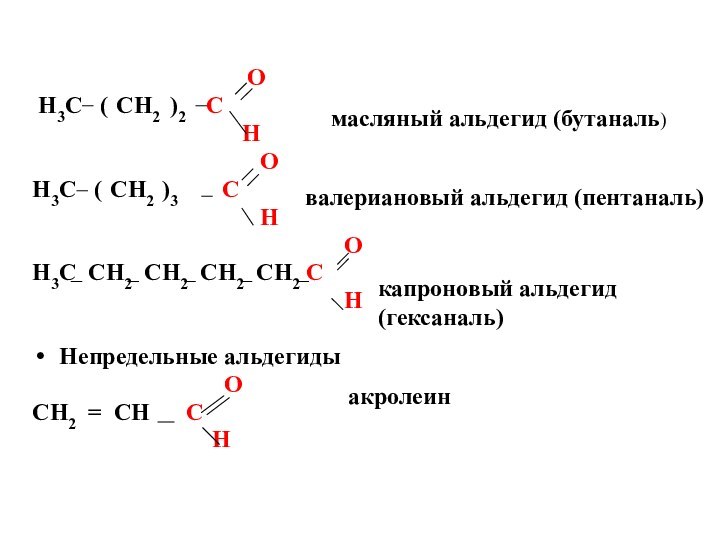
O
H3C ( CH2 )2 C
H
O
H3C ( CH2 )3 C
H
O
H3C CH2 CH2 CH2 CH2 C
H
Непредельные альдегиды
O
CH2 = CH С
H
масляный альдегид (бутаналь)
валериановый альдегид (пентаналь)
капроновый альдегид
(гексаналь)
акролеин
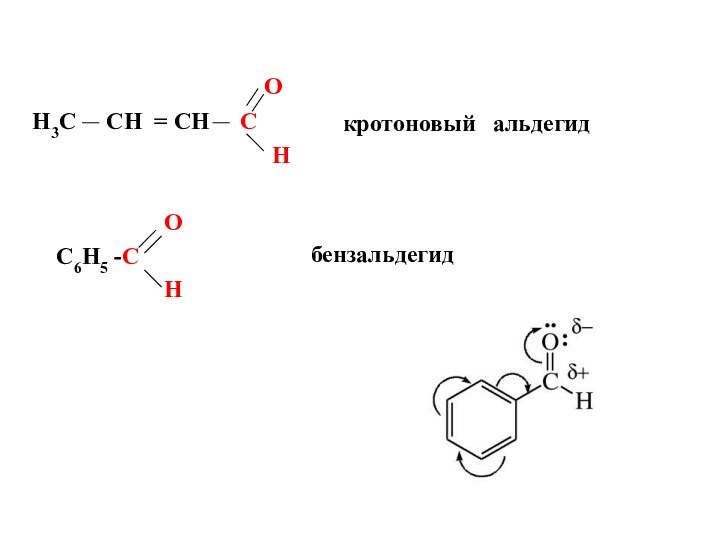
O
H3C
CH = CH C
H
O
C6H5 -C
H
кротоновый альдегид
бензальдегид
Слайд 34
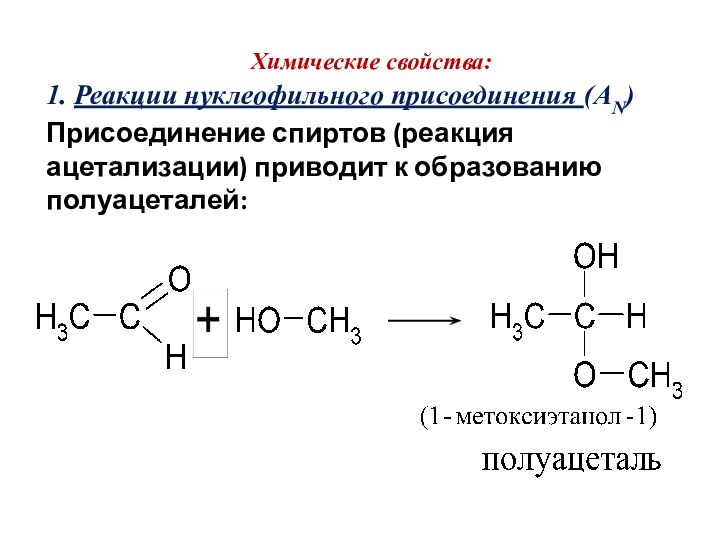
Химические свойства:
1. Реакции нуклеофильного присоединения (AN)
Присоединение спиртов (реакция
ацетализации) приводит к образованию полуацеталей:
Слайд 35
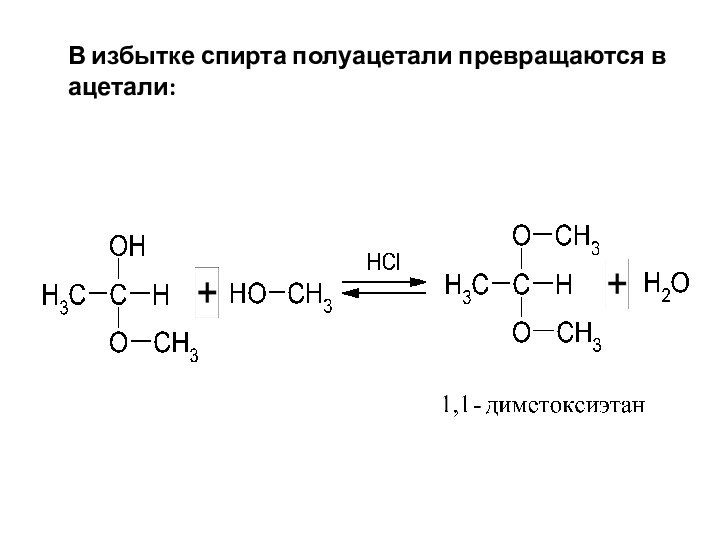
В избытке спирта полуацетали превращаются в ацетали:
Слайд 36
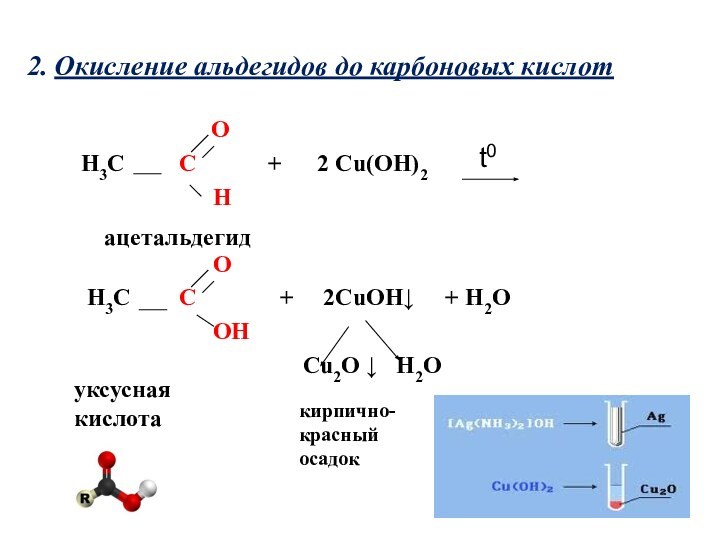
2. Окисление альдегидов до карбоновых кислот
O
H3C C + 2 Cu(OH)2
H
O
H3C C + 2CuOH↓ + H2O
OH
Cu2O ↓ H2O
ацетальдегид
уксусная кислота
t0
кирпично-
красный
осадок
Слайд 37
3. Альдольная и кротоновая конденсация
Под влиянием основных
катализаторов альдегиды реагируют с образованием продуктов, имеющих удвоенную молекулярную
массу по сравнению с исходной молекулой.
В организме реакции конденсации происходят в присутствии ферментов альдолаз по механизму AN
Некоторые кетоны тоже способны к этой реакции, только в более жестких условиях.
Слайд 38
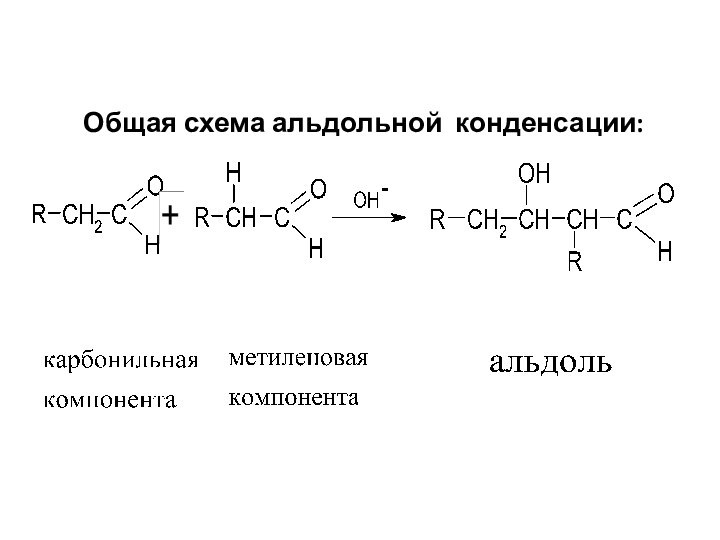
Общая схема альдольной конденсации:
Слайд 39
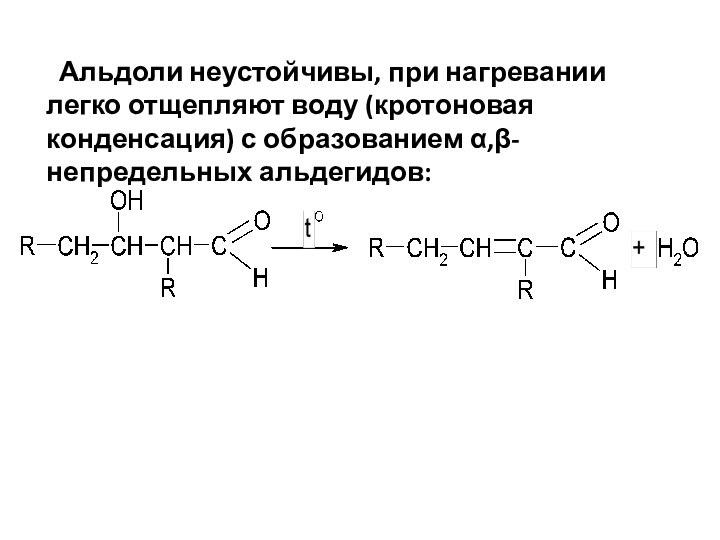
Альдоли неустойчивы, при нагревании легко отщепляют воду
(кротоновая конденсация) с образованием α,β-непредельных альдегидов:
Слайд 40
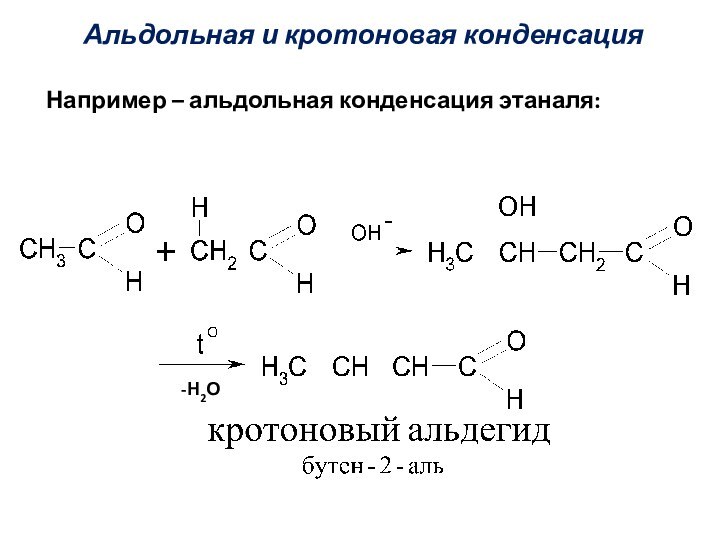
Альдольная и кротоновая конденсация
Например – альдольная конденсация этаналя:
-Н2О