Слайд 2
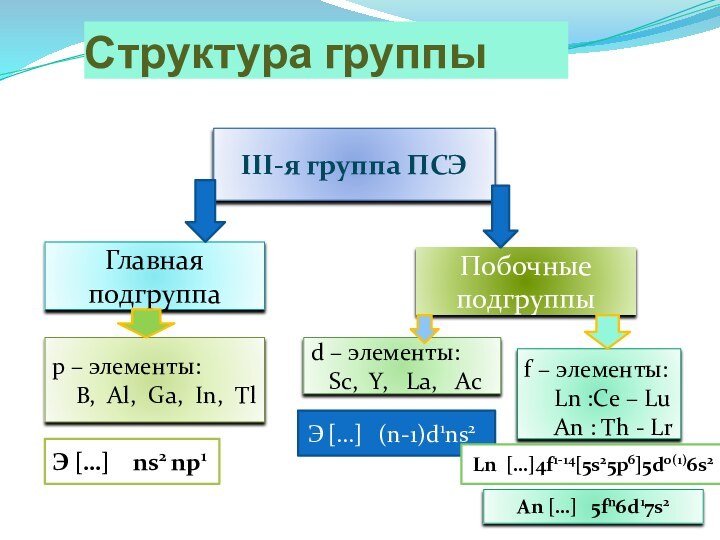
Структура группы
III-я группа ПСЭ
Главная подгруппа
Побочные подгруппы
p – элементы:
B, Al, Ga, In, Tl
d – элементы:
Sc, Y, La, Ac
f – элементы:
Ln :Ce – Lu
An : Th - Lr
Э […] ns2 np1
Э […] (n-1)d1ns2
Ln […]4f1-14[5s25p6]5d0(1)6s2
An […] 5fn6d17s2
Слайд 3
Свойства элементов III группы
Общие свойства:
Все элементы имеют
общую валентность III и общий состав химических соединений.
Элементы характеризуются
металлическими свойствами ,за исключением бора.
Для оксидов Э2О3 и гидроксидов Э(ОН)3 характерны основные свойства ,
кроме Al, Ga, Sc.
Элементы имеют подобные растворимые и нерастворимые соединения.
Слайд 4
различные свойства
Элементы главной подгруппы имеют иное электронное строение.
Являются
p-элементами (менее активные металлы).
d- и f- элементы имеют на внешнем уровне ns- два электрона, поэтому являются типичными металлами
Различие в свойствах элементов побочных подгрупп определяется электронным строением предшествующих электронных слоев.
Слайд 5
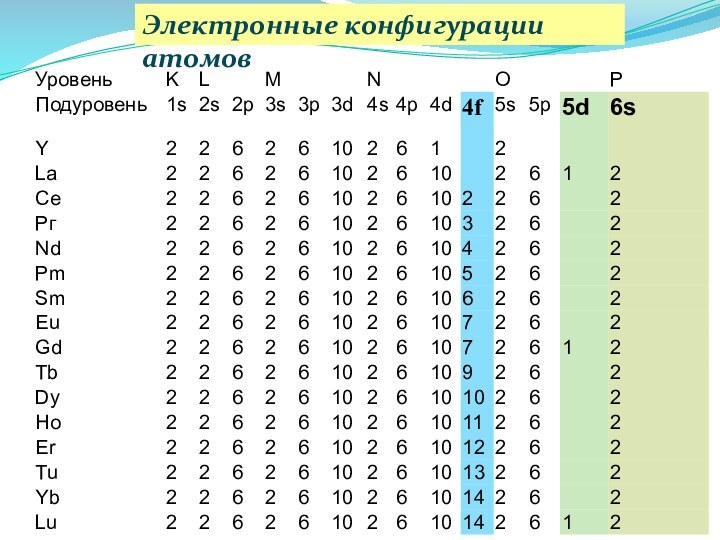
Электронные конфигурации атомов
Слайд 7
Характеристика РЗЭ
Лантаноиды – элементы, следующие за лантаном и
имеющие сходные с ним свойства.
Лантаноиды относятся к f-элементам
и имеют общее электронное строение:
Ln […]4f1-14[5s25p6 ]5d0(1) 6s2
Лантан, гадолиний и лютеций склонны проявлять только валентность равную III
Церий, празеодим, тербий могут проявлять как валентность III, так и валентность IV
Самарий, Европий, иттербий могут проявлять валентность II
Радиусы атомов и ионов РЗЭ уменьшаются от La к Lu - эффект «лантаноидного сжатия»
Слайд 8
РЗЭ реагируют с водой (при нагревании – быстро).
2РЗЭ0+6H+2O
2РЗЭ+3(OH)3+3H02
РЗЭ0-3е РЗЭ+3
2H+ +2еH02
Замещаются металлами:
2РЗЭ+3Cl3+3Ca0 t2РЗЭ0+3Ca+2Cl2
РЗЭ+3+3еРЗЭ0
Ca0-2еCa+2
Слайд 9
Основные химические свойства РЗЭ
На воздухе легкие Ln окисляются
при комнатной t,
Остальные - при t = 180-200 °С:
4Ln0+3O20
t2Ln2+3O3-2
Ln0-3еLn+3
O02+4е 2O-2
Се и богатые Се сплавы пирофорны.
Се0+О20Се+4О2-2
Се0- 4еСе+4
O02+ 4е 2O-2
С галогенами взаимодействуют при невысокой температуре
2РЗЭ+3Cl2 t 2РЗЭCl3
РЗЭ0-3е РЗЭ+3
Cl02+2е 2Cl-
интенсивность взаимодействия уменьшается от фтора к йоду.
Слайд 10
РЗЭ реагируют с кислотами
2РЗЭ+3H2SO4РЗЭ2(SO4)3+3H2
РЗЭ0-3е РЗЭ+3 2
2H+
+2еH02 3
8РЗЭ0+30HN+5O33N-3H4NO3+8РЗЭ(NO3)3+9H2O
РЗЭ0-3е РЗЭ+3
N+5+8е N-3
Реагируют с солями:
РЗЭ2(SO4)3 +3Na2CO3РЗЭ2(CO3)3 +3Na2 SO4
РЗЭ+3+3NH4FРЗЭ F3+3NH4+
Щелочи на них не действуют даже при нагревании.
РЗЭ+NaOH tне идет
Слайд 11
Cвойства церия и его соединений
Слайд 12
Cвойства церия
Электронная конфигурация атома церия
58Се [
] 4f 2[5s25p6]5d06s2
Церий активный металл.
Церий
взаимодействует при нагревании с большинством неметаллов (O2, H2, N2, Cl2, C, S, P и т.д.) с образованием соответствующих бинарных соединений.
2Ce + N2 2CeN
Бурно взаимодействует с кислородом
Ce + O2 → CeO2
Слайд 13
Хим. свойства церия
Реагирует с водой с выделением
Н2.
В ряду активности Церий и др. лантаноиды можно
расположить между Са и Mg.
Се +3Н2ОCe (OН)3+3H2
Карбонаты церия горят на воздухе
Ce+32(CO3)3 + O02 t Ce+4O2 + 6CO2.
Се+3-еСе+4 4 восстановитель Eвос=1.61 В;
O02 +4е2O-2 1 окислитель Еок=1.23 В;
E = Eок-Eвос =-0.38
Ce+32(C2O4)3 + O02 t 2Ce+4O2 + 6CO2
Слайд 14
Свойства соединений церия Ce3+
Кислотно-основные свойства Ce(OH)3
Гидроксид в
водных растворах проявляет основной характер.
2Ce(OH)3+3H2SO4Ce2(SO4)3 + 3H2O
Ce(OH)3+NaOH;
Ce(NO3)3+3NaOH
Ce(OH)3(бел.)+3NaNO3;
Слайд 15
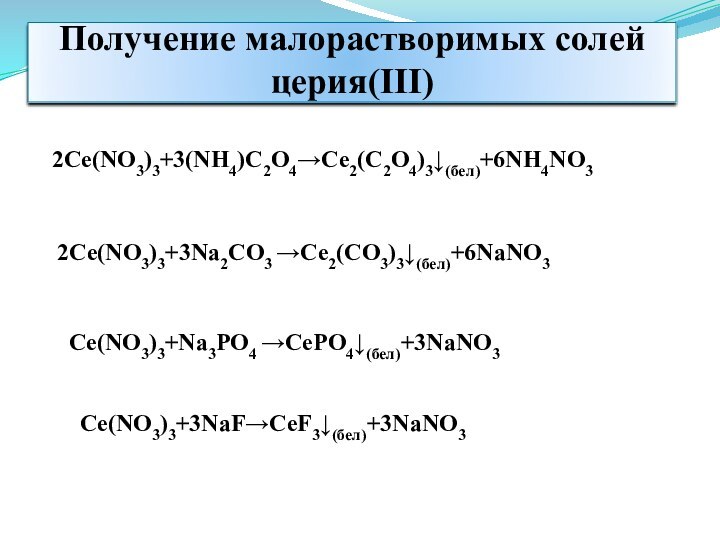
Получение малорастворимых солей церия(III)
2Ce(NO3)3+3(NH4)C2O4Ce2(C2O4)3(бел)+6NH4NO3
2Ce(NO3)3+3Na2CO3 Ce2(CO3)3(бел)+6NaNO3
Ce(NO3)3+Na3PO4 CePO4(бел)+3NaNO3
Ce(NO3)3+3NaFCeF3(бел)+3NaNO3
Слайд 16
Ce3+ + окислитель Ce4+
3Ce+3(OH)3 + KMn+7O4
+ 2H2O 3Ce+4(OH)4 + Mn+4O2 + KOH
Се+3-еСе+4
3 Eвос=1.61 В;
Mn+7+3е Mn+4 1 Еок=0.6 В;
E = Eок-Eвос =1,01 В.
2Ce (NO3)3+NaBi+5O3+6HNO3 2Ce(NO3)4(ж.)+Bi+3(NO3)3+NaNO3+3H2O(pH<7)
Bi+5+2eBi+3 1 Eок=1.86 В
Ce+3-eCe+4 2 Eвос=1.61В
E = Eок-Eвос = 0,25В.
Окислтельно-восстановительные свойства Ce3+
Слайд 17
Свойства Ce4+.
Кислотно - основные:
Слабые амфотерные
свойства Ce(OH)4 проявляет только при высоких температурах( при спекании
с щелочью):
Ce(SO4)2(жёлт.)+4NaOHCe(OH)4(бел.)+2Na2SO4
Ce(OH)4+NaOHводный р-р
Ce(OH)4 + 2NaOН(тв) t Na2CeO3 + 3H2O
Ce(OH)4 +2H2SO4 Ce(SO4)2 + 4H2O
Слайд 18
Окислительно-восстановительные свойстваCe(IV)
2Ce(SO4)2+2KI I2+K2SO4+Ce2(SO4)3 (pH
Eок=1.61 В; 2
2I--2eI2 восстановитель Eвост=-0.54 В; 1
Ер=Еок-Евост=1.07 В;
2Ce(SO4)2+H2O2Ce2(SO4)3+O2+H2SO4
Ce+4+eCe+3 окислитель Еок=1.61 В; 2
O2-2-2eO20 восстановитель Евост=1.23 В; 1
Ер=Еок-Евост=0. 38 В.
Слайд 19
Ионы Ce4+ - сильные окислители в кислых средах
2Ce+4(OH)4+8HCl-12Ce+3Cl3+Cl2+8H2O
Ce+4+eCe+3
2 ок-ль Еок=1.61В;
2Cl-1-2eCl20 1 в-ль Евост=1.36 В;
Ер=Еок-Евост=0,25 В;
Ce+3Cl4
Ce+3Br4
Ce+3I4
2Ce(SO4)2+2KI I2+K2SO4+Ce2(SO4)3 (pH<7)
Слайд 20
Ce(C2O4)2 + 2(NH4)2C2O4 (NH4)4[Ce(C2O4)4]
Ce2(C2O4)3 + (NH4)C2O4
не идёт.
Отделение Ce от других РЗЭ
В основе —
способность церия проявлять степень окисления +4.
Ce(OH)3 + 3HCl CeCl3 + 3H2O.
РЗЭ(OH)3 + 3HCl РЗЭCl3 + 3H2O (pH = 6,5)
2H2O+CeCl3+KMnO4+8NaOHCe(OH)4 +MnO2 +KCl+8NaCl
Слайд 21
Качественные реакции на ионы церия.
Ce(NO3)3+3NH4OH Ce(OH)3(бел.)+3NH4NO3
2Ce(OH)3+H2O22Ce(OH)4(желт.) (pH
> 7);
Се+3-еСе+4 восстановитель Eвос=1.61
В;
O2-2 + 2e2O-2 окислитель Еок=1.77 В;
Ер=Еок-Евост=0.16 В.
Ce(OH)4+H2O2Ce(OH)3(OOH)(оранж.)+H2O (pH > 7)
Слайд 22
отделение скандия от РЗЭ
Sc+3+3NH4F ScF3 +3NH4+
РЗЭ+3+3NH4FРЗЭ
F3 +3NH4+
ScF3+3NH4F (NH4)3[ScF6]
РЗЭ F3 + NH4F
Отделение
Eu от других РЗЭ.
связано с способностью образовывать труднорастворимый сульфат
2EuCl3+Zn+2H2SO42EuSO4 +ZnCl3+4HCl
Eu3+ +e Eu2+окислитель Еок=-0.55 В; 2
Zn0-2e Zn2+восстановитель Евост.=-0.762 В; 1
Ер=Еок-Евост=0.212 В;
Eu2(SO4)3+Zn 2EuSO4 +Zn SO4
РЗЭ2(SO4)3+Zn
EuC2+ 2H2O Eu(OH)2 +C2H2(ацетилен)
РЗЭ+Zn
Слайд 24
электронное строение
Аn 5f k 6d m
7s2,
где k изменяется от 2 до 14,
а
m равно 0 или 1
Различие в энергиях 5f- и 6d-орбиталей меньше, чем 4f- и 5d-орбиталей
Поэтому легкие актиноиды характеризуются
большим разнообразием степеней окисления, и более
склонны к образованию комплексных соединений,
чем лантаноиды.
Слайд 25
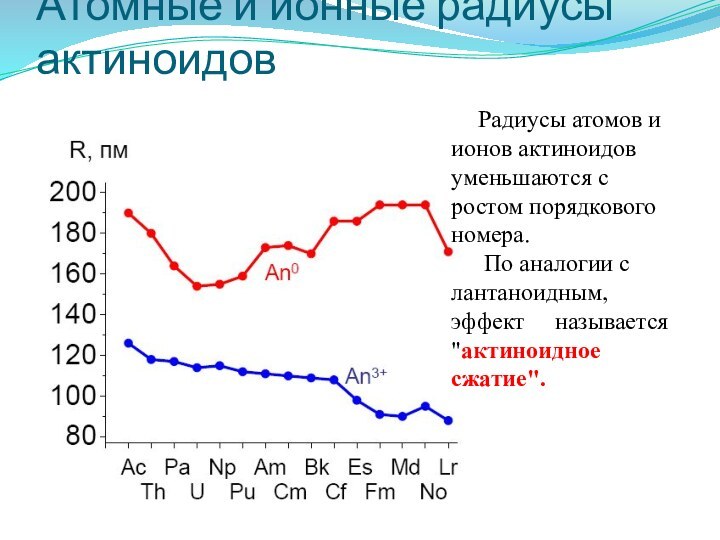
Атомные и ионные радиусы
актиноидов
Радиусы атомов и ионов актиноидов
уменьшаются с ростом порядкового номера.
По аналогии с лантаноидным,
эффект называется "актиноидное сжатие".
Слайд 26
Химические свойства актиноидов
Обладают большой склонностью к комплексообразованию,
особенно с кислородсодержащими лигандами ;
В ряду легких актиноидов (от
актиния до америция) свойства элементов сильно различаются
В ряду тяжелых актиноидов (от кюрия до лоуренсия) они в значительной степени аналогичны и похожи на свойства лантаноидов;
Слайд 27
Свойства тория
Электронная формула 6d 2 7s2
Природный
торий содержит практически один изотоп 232Th,
период полураспада равен
1,4·1010 лет
Основная степень окисления +4
Слайд 28
Свойства тория
Торий — активный металл, по реакционной способности
близкий к лантаноидам, но отличается от них степенью окисления
При
нагревании торий реагирует со многими неметаллами:
O2 , Н2, С, Cl2, Br2, S, N2
Слайд 29
Торий взаимодействует с азотом при 800 °C с
образованием нитрида тория ThN(t 2500 °С) ,
2Th +
N2 2ThN
Взаимодействия тория с углеродом
Th + C ThC
Th + 2C ThC2
карбиды разлагаются водой с образованием углеводородов.
ThC + 4H2O Th(OH)4 + CH4↑
ThC2 + 4 H2O Th(OH)4 + C2H4↑
Слайд 30
Взаимодействие тория с водой и кислотами
Торий - активный
восстановитель (Е о = -1,9 В)
Торий вытесняет водород из
кипящей воды
Th + 4H2O Th(OH)4 + 2H2↑
медленно растворяется в разбавленных фтороводородной, азотной или серной кислотах
Th +2H2SO4(разб) Th (SO4)2 + 2H2↑
Th + 4HF(разб) ThF4 + 2H2↑
Слайд 31
Соединения тория (IV)
Th(OH)4 - имеет основной характер
Th
(SO4)2 + 4NH4OH → Th (OH)4↓ +2(NH4)2SO4
Th (OH)4↓
ThO2 + 2H2O
Th (OH)4↓ + 4HCl(разб) ThCl4 + 2H2O
Th (OH)4↓ + CO2 → Th OCO3↓ + H2O
к растворимым в воде соединениям относятся нитраты, хлориды и сульфаты тория (IV)
Гидролиз солей
Th(NO3)4 + H2O ThO(NO3)2 + 2HNO3
Th(NO3)4 + 2Na2 CO3 + H2O ThO CO3 + H2CO3 + 4NaNO3
Слайд 32
комплексообразование
В водных растворах торий образует комплексные соединения с
КЧ=6, 8 и реже 10 или 12. Комплексообразование используют
для растворения труднорастворимых соединений тория (карбонатов, оксалатов).
ThOCO3↓ + 3Na2CO3 + H2O → Na4[Th(CO3)4] + 2NaOH
Th(C2O4)2 ↓ + 2(NH4)2C2O4 → (NH4)4[Th(C2O4)4]
Слайд 33
Получение тория
минерал монацит вскрывают сернокислотным или щелочным способом
Th3(PO4)4+12NaOH → 3Th(OH)4↓+4Na3PO4
оксид тория ThO2 подвергают металлотермическому восстановлению
кальцием в атмосфере инертного газа:
ThO2+2Ca Th + 2CaO
электролиз расплава галогенида тория
ThF4 или ThCl4.
Слайд 35
Уран
Уран — самый тяжелый из встречающихся в природе
элементов
Его содержание в земной коре составляет 3·10-4 % по
массе
Он имеет три изотопа:
99,28% природного урана составляет изотоп 238U,
период полураспада которого равен 4,5·109 лет;
0,715 % – изотоп 235U с периодом полураспада 7,1·108 лет;
0,005 % – изотоп 234U с периодом полураспада 2,47·105 лет.
Изотоп 233U получен в результате ядерных реакций.
Слайд 36
Электронное строение и СО урана
U 5f
36d 17s2
степени окисления от +3 , +4, +5, +6,
наиболее устойчивыми среди них являются степени окисления +4 и +6
в степени окисления +6 – амфотерные свойства;
Его температура плавления равна 1132 °C
Он химически активен и реагирует со многими элементами периодической системы.
Слайд 37
Свойства урана
Уран имеет очень высокое сродство к кислороду
U + O2
UO2 UO3 U3O8 )
2U + N2 2UN
U + C UC
U + 2C UC2
UC + 4H2O U(OH)4 + CH4↑
UC2 + 4H2O U(OH)4 + C2H4↑
U + 3F2 UF6
U + 3Cl2 UCl6
Слайд 38
Свойства U(IV)
Безводный тетрафторид получают из диоксида урана
UO2+4HF UF4↓+2H2O
восстановлением гексафторида
урана различными восстановителями, например, водородом
UF6+H2 UF4↓+2HF
Слайд 39
Свойства U(IV)
U(IV) -аналог Th4+
характерны:
основные свойства
Гидролиз
U (NO3)4
+ H2O UOH(NO3)3
+ HNO3
Комплексообразование
ОВР
Слайд 40
Под действием окислителей уран (IV) переходит в уран
(VI)
U(SO4)2 + 2Ce(SO4)2 + 2H2O →
UO2SO4 + Ce2(SO4)3 + 2H2SO4
2U(SO4)2 + 2KMnO4 + 2H2O → 5UO2SO4 + 2MnSO4 + KHSO4 + H2SO4
Под действием восстановителей уран (IV) переходит в уран (I I I)
2U(SO4)2 + Zn + → U2(SO4)3 + ZnSO4
Слайд 41
Свойства U(VI)
Гидролиз солей:
UCl6 + 2H2O
→ UO2Cl2 + 4HCl
Амфотерность:
при растворении в кислотах образуются
соли диоксоурана
UO2(OH)2 + H2SO4 → UO2SO4 + 2H2O
при растворении в концентрированных щелочах – уранаты
UO2(OH)2 +2NaOH → Na2UO4 + 2H2O
или диуранаты
2UO2(OH)2 +2NaOH → Na2U2O7 + 3H2O
Слайд 42
комплексообразование
Трикарбонатный комплекс катиона диоксоурана хорошо растворим
UO2SO4
+ 3Na2CO3 → Na4[UO2(CO3)3] + Na2
SO4
(NH4)2U2O7↓ + 6(NH4)2CO3 + 3H2O → 2(NH4)4[UO2(CO3)3] + 6 NaOH
В карбонатных комплексах иона диоксоурана два координационных места заняты атомами кислорода
Слайд 43
Окислительно-восстановительные свойства
U6+ окислитель
восстановление шестивалентного урана проводят
электрохимически или с использованием таких металлов, как железо или
цинк:
UO2SO4 + Zn + 2H2SO4 → U(SO4)2 + ZnSO4 + 2H2O
Слайд 44
Получение и очистка урана
Металлический уран получают восстановлением тетрафторида
урана UF4 кальцием или магнием в инертной атмосфере:
UF4+2Ca
U + 2CaF2
урана
Для урана известно около 200 минералов
промышленное значение имеет минерал
настуран (урановая смолка) U3O8
урановую смоляную руду, обрабатывают минеральными кислотами, например азотной или серной кислотой, в присутствии MnO2, для окисления урана(IV):
U3O8 + MnO2 + 4H2SO4 → MnSO4 + 3UO2SO4 + 4H2O
Слайд 47
Классификация методов разделения по фазовому состоянию системы
Слайд 48
Характеристики процесса разделения
1.Коэффициент распределения
Di = Ci/Ci
2. Коэффициент разделения
Di- коэфф. распределения основного в-ва
Dj- коэфф. распределения примеси
При значениях D>1 вещество можно сконцентрировать в извлекающей фазе
при β>1
Разделение веществ возможно
Чем больше β отличается от единицы, тем более избирателен (селективен) метод разделения.
Слайд 49
Методы разделения
химические методы
физико-химические методы
осаждение,
растворение,
цементация,
сорбция,
экстракция,
электроосаждение,
электрорастворение,
транспортные реакции,
физические методы
термодиффузию,
кристаллизацию,
зонная плавка, ультрацентрифугирование
Слайд 50
химические методы
В их основе лежит применение специфических реагентов,
которые по-разному взаимодействуют с основным и примесными компонентами, позволяя
перевести один из них в газовую или твердую фазы.
В качестве специфических реагентов могут служить минеральные кислоты, щелочи, окислители, комплексообразователи
Слайд 51
Осаждение
Основан на различной растворимости компонентов растворов.
Для отделения
от примесей используют селективные осадители и промывку полученных осадков
на фильтре.
Ag++Cl- = AgCl↓,
Ba2++SO42- = BaSO4↓
Коэффициент разделения для процессов осаждения
β = ПРi/ПРj
отделение скандия от
РЗЭ и тория
ScF3+3NH4F = (NH4)3[ScF6]
растворим
Слайд 52
в качестве осадителей могут применяться чистые металлы, которые
вытесняют из растворов более электроположительные металлы.
цементация
например, получение меди
из ее разбавленных р-ров:
CuSO4+Fe = Cu↓+FeSO4
также очищают сульфатные цинковые растворы
от примеси меди и кадмия:
CuSO4+Zn = Cu↓+ZnSO4
CdSO4+Zn = Cd↓+ZnSO4








![Свойства элементов iii группы Cвойства церияЭлектронная конфигурация атома церия 58Се [ ] 4f 2[5s25p6]5d06s2](/img/tmb/14/1308289/4e008d64f41b4cddd3cc6b3622fe427e-720x.jpg)






![Свойства элементов iii группы Ce(C2O4)2 + 2(NH4)2C2O4 (NH4)4[Ce(C2O4)4] Ce2(C2O4)3 + (NH4)C2O4 не идёт.Отделение Ce от](/img/tmb/14/1308289/cd58215f24978517106ca0eda2764fdc-720x.jpg)

![Свойства элементов iii группы отделение скандия от РЗЭSc+3+3NH4F ScF3 +3NH4+РЗЭ+3+3NH4FРЗЭ F3 +3NH4+ScF3+3NH4F (NH4)3[ScF6]РЗЭ](/img/tmb/14/1308289/e8af6e0d3ce050d5dbad44cb13a4a3b3-720x.jpg)