Слайд 2
Восстановление дефектного гена delF508 муковисцидоза при стимуляции генного
биосинтеза нанокристаллами галлуазита
Представлены экспериментальные данные по активации дефектного гена
белка CFTR delF508 при муковисцидозе с помощью генноинженерного метода с использованием донорской ДНК и нанокристаллов галлуазита.
Цель работы: изучить применение кристаллов галлуазита для доставки чужеродных (донорских) генов в клетки и геном пациента клетками поджелудочной железы модельных животных in vivo и исследовать эффективность применения нанокристаллов галлуазита содержащие генноинженерные конструкции для восстановления дефектного гена delF508 и синтезе трансмембранного белка CFTR .
Слайд 3
Методы генной терапии муковисцидоза в мире
Применение ретровирусов;
Применение репликационно
аденовирусы и липосомы;
На людях проводились исследования на эпителии полости
носа, наблюдалось приближение свойств больного эпителия к нормальному;
Доставка экспресирующих конструкций гена CFTR с помощью липосом;
Стволовые клетки (Dr. Greko, 2014);
Синтетические микросферы для доставки генетических конструкций в клетки дыхательного эпителия легких мышей с использованием двух типов плазмид содержащих маркерный ген LacZ – c цитоплазматической и ядерной локализацией β-галактозидазы – продукт экспресии гена показали высокую перспективность лечения муковисцидоза (Глазков П. В., Мишкина Е. Н., Гембицкая Т. Е.).
Слайд 4
Мутация гена delF508
Мутация гена delF508 – наиболее часто

встречающаяся мутация (более 55% из всех выявляемых мутаций) выпадение
3 нуклеотидов (триплет 508).
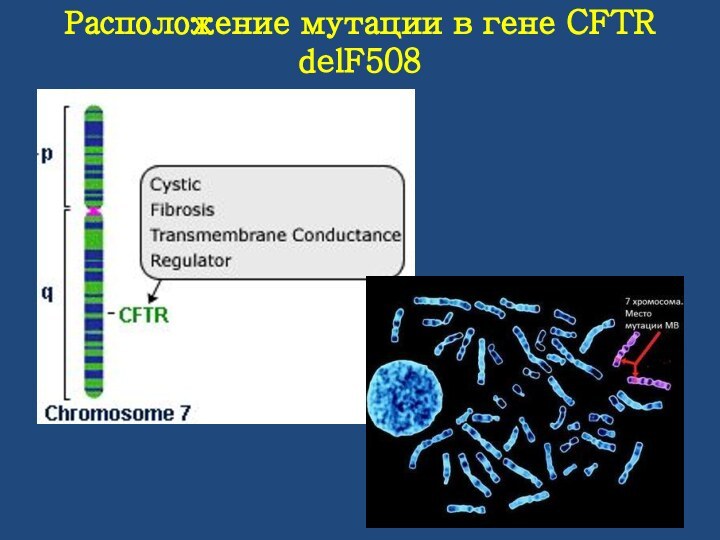
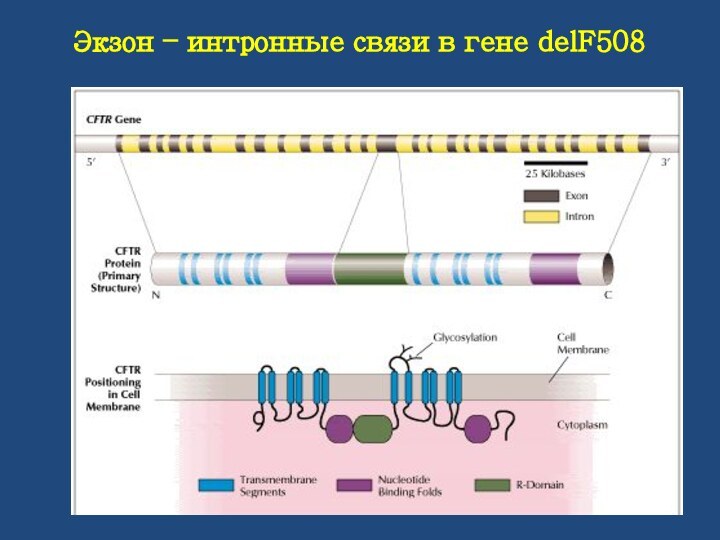
Расположен ген на длинном плече 7-й хромосомы, размер гена белка CFTR составляет 250 500 пар нуклеотидов и разбивается на 27 экзонов. Размер экзонов варьирует от 38 до 724 нуклеотидов, величина интронов колеблется от 1100 до 40 000 нуклеотидов.
Зрелая матричная мРНК состоит из 6500 нуклеотидов, кодирующие полипептидную цепь трансмембранного регуляторного белка длиною из 1480 аминокислотных остатков.
Трансмембранный регуляторный белок состоит из 12 мембраносвязывающих областей и 2 АТФ-связывающих доменов.
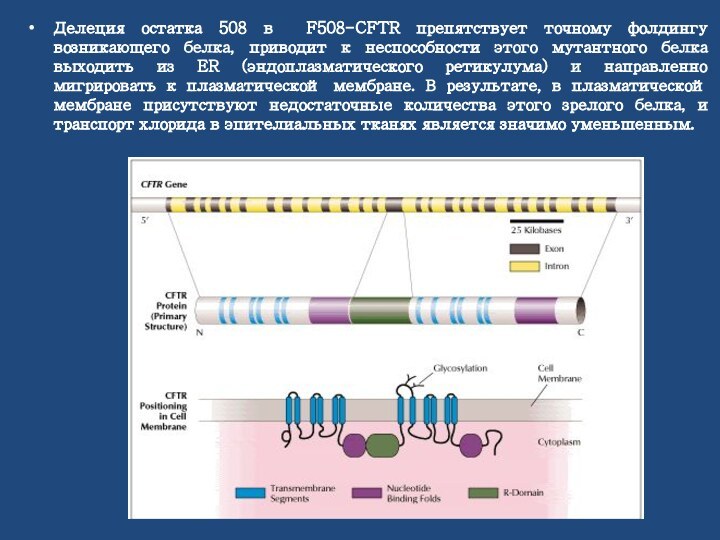
Делеция остатка 508 в F508-CFTR препятствует точной укладке возникающего белка. Это приводит к неспособности мутантного белка выходить из ER (эндоплазматического ретикулума) и направленно мигрировать к плазматической мембране. В результате, число каналов, присутствующих в этой мембране, является гораздо меньшим, чем число каналов, наблюдаемое в клетках, экспрессирующих CFTR дикого типа. Кроме нарушенной направленной миграции эта мутация приводит к дефектному воротному механизму ионных каналов. Вместе это уменьшенное число каналов в мембране и дефектный воротный механизм каналов приводят к уменьшенному транспорту через эпителий, приводя к дефектному транспорту ионов и жидкости
Слайд 5
Делеция остатка 508 в F508-CFTR препятствует точному фолдингу
возникающего белка, приводит к неспособности этого мутантного белка выходить
из ER (эндоплазматического ретикулума) и направленно мигрировать к плазматической мембране. В результате, в плазматической мембране присутствуют недостаточные количества этого зрелого белка, и транспорт хлорида в эпителиальных тканях является значимо уменьшенным.
Слайд 6
Расположение мутации в гене CFTR delF508
Слайд 7
Экзон – интронные связи в гене delF508
Слайд 9
Экспериментальная часть
1. Предварительно экспериментально пересадили клетки от больного
человека муковисцидозом атимусным иммунодефицитным мышам линии nu/nu.
Создаем контрольную
и опытную группы животных.
Определяем у всех уровень ионов хлора и натрия ионоселективным методом на биохимическом анализаторе «Сапфир», Япония, первичную структуру белков, показатели составляют: натрий- 198,8 ммоль/л, хлор – 83,1 ммоль/л.
Иммунореактивный трипсин – 19,1 мкг/л (набор набор Blood Spot Trypsin-MW ELISA) из сухого пятна фильтровальной бумаги;
Слайд 10
В контрольной группе определяем те же показатели:
уровень хлора
равен – 240 ммоль/л;
натрия – 311 ммоль/л;
Иммунореактивный трипсин –
30 мкг/л
Положительные результаты спектров при сканировании проб при проведении ДНК теста с помощью ДНК – чипа компании Алкор - Био
Слайд 11
Проводим определение мутацийс помощью ДНК – чипа (компания
Алкор-Био)
По следующему алгоритму: амплификация интересующих фрагментов ДНК животного в
ходе двухстадиной полимеразной цепной реакции
2. Гибридизация полученных продуктов ПЦР на стекле микрочипа
3. Сканирование флуоресценции микрочипа
4. Анализ результатов
2. Выделяем донорскую ДНК от контрольной группы животных:
Лизис клеток (лизирующий раствор ЭДТА и протеиназа К);
Солюбилизация ДНК на специальной мембране;
Отмывание проб от клеточных структур;
Элюирование ДНК из мембраны;
Ген выделяем механическим дроблением (метод Бэквитса);
3. Нанокристаллы галлуазита обрабатываем эндонуклеазойдобавляем выделенную ДНК обрабатываем трансферазойтаким образом к кристаллам пришиваются комплементарные гомополимерные последовательности (поли А и поли Т, Ц и Г)
Слайд 12
Полученные компоненты обрабатываем полинуклеотидлигазой
4. Насыщение кристаллов галлуазита проводим
добавлением к раствору кристаллов ДНК в концентрации 5 мкМ
и обрабатываем ультразвуком в течении 30 минут, инкубируем при 37 С в термостате 40 мин, затем раствор центрифугируем 14000 g при комнатной температуре до обесцвечивания супернатанта.
Нанокристаллы галлуазита
Слайд 13
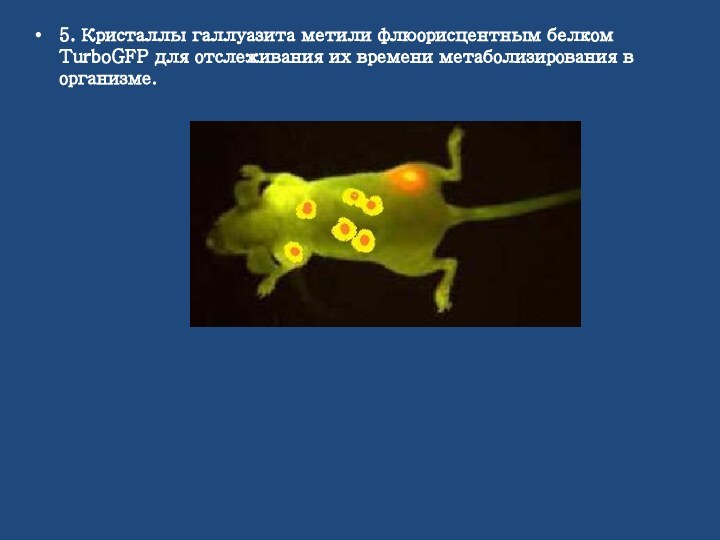
5. Кристаллы галлуазита метили флюорисцентным белком TurboGFP для
отслеживания их времени метаболизирования в организме.
Слайд 14
Введение кристаллов в хвостовую вену
Введение кристаллов с ДНК
производилось в течении 3 недель с интервалом 2 дня
беременным самкам модельных животных линии nu/nu .
Слайд 15
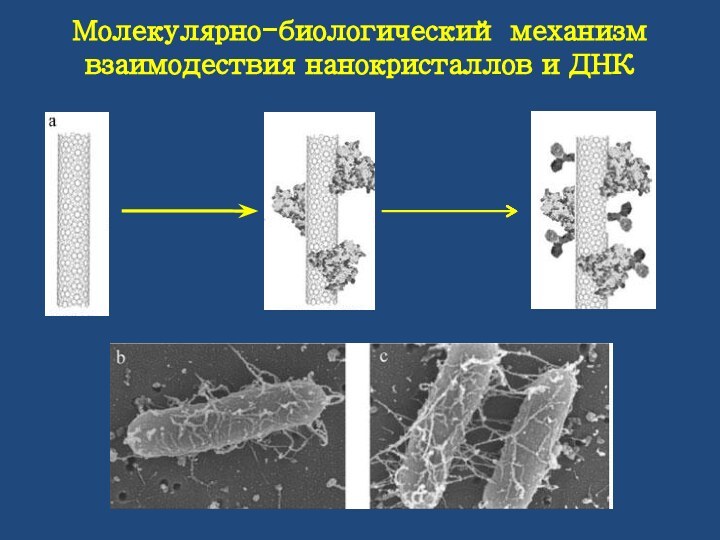
Молекулярно-биологический механизм взаимодествия нанокристаллов и ДНК
Слайд 16
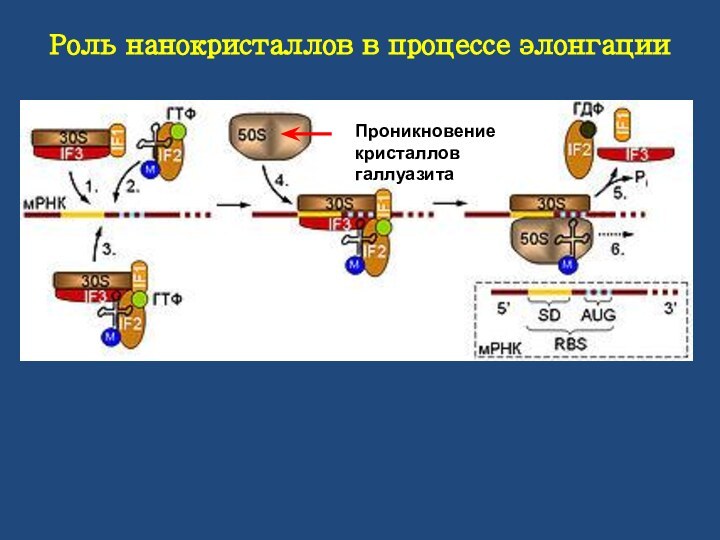
Роль нанокристаллов в процессе элонгации
Проникновение кристаллов галлуазита
Слайд 17
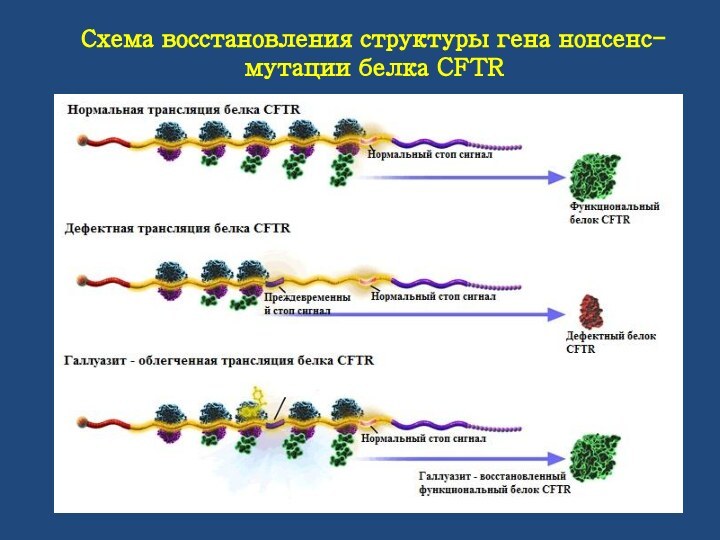
Схема восстановления структуры гена нонсенс-мутации белка CFTR
Слайд 18
Результаты исследования:
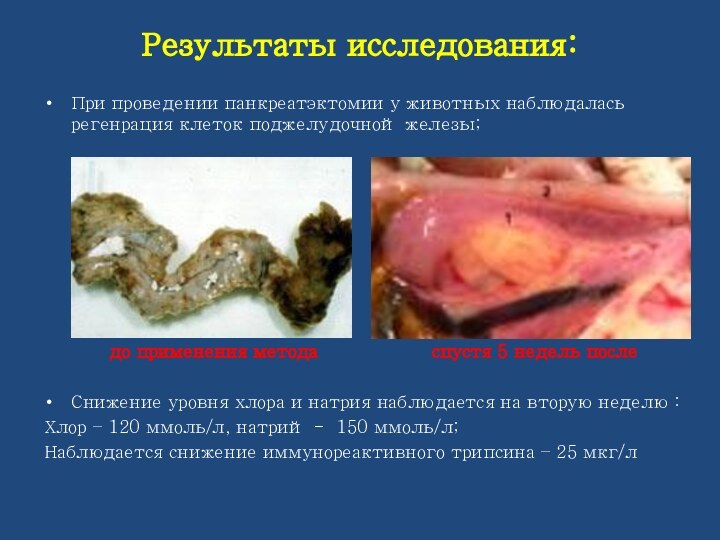
При проведении панкреатэктомии у животных наблюдалась регенрация
клеток поджелудочной железы;
до
применения метода спустя 5 недель после
Снижение уровня хлора и натрия наблюдается на вторую неделю :
Хлор – 120 ммоль/л, натрий - 150 ммоль/л;
Наблюдается снижение иммунореактивного трипсина – 25 мкг/л
Слайд 19
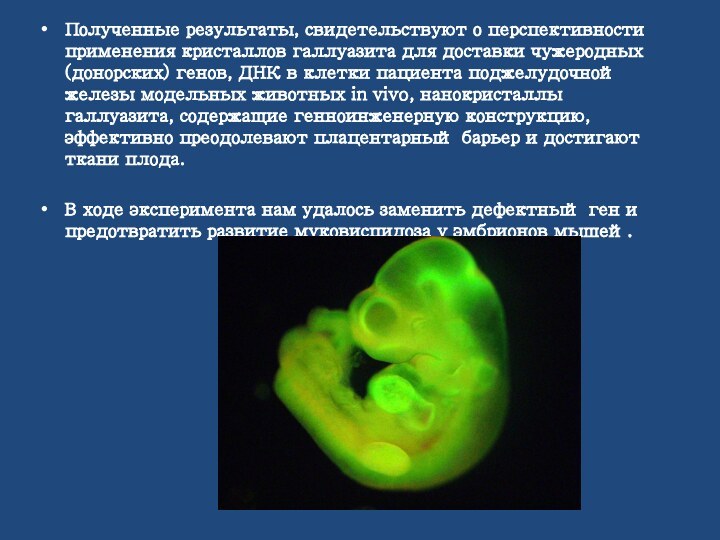
Полученные результаты, свидетельствуют о перспективности применения кристаллов галлуазита
для доставки чужеродных (донорских) генов, ДНК в клетки пациента
поджелудочной железы модельных животных in vivo, нанокристаллы галлуазита, содержащие генноинженерную конструкцию, эффективно преодолевают плацентарный барьер и достигают ткани плода.
В ходе эксперимента нам удалось заменить дефектный ген и предотвратить развитие муковисцидоза у эмбрионов мышей.
Слайд 20
Выводы
Метод позволяющий восстанавливать дефектный ген delF508 и синтез
трансмембранного белка CFTR;
Метод не требует применения донорских стволовых клеток,вируса
ВИЧ человека, ретровирусов, химиотерапии, хирургического вмешательства;
Кристаллы высокобиосовместимы с геномом млекопитающих,
Быстро биодеградируют и метаболизируются в организме без токсического влияния;
Восстанавливают гуморальный, электронный и молекулярные механизмы клетки.
В данной работе реализовалось возобновление функции гена путем его исправления, разблокированием, дополнением.
Наше внимание привлекает использование галлуазита для нормализации работы генов в больших массивах клеток, как средство при извлечении токсинов из клеток, при лечении онкологических заболеваний.