С5–С6, арены, гетероциклы)
Уголь: коксование → каменноугольная смола (арены)
Биомасса (изопреновые
комбинации)
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть










![Природные источники веществ (органика Изопреновые комбинации в природеТерпены – «диизопрены»Ди-, три-, тетратерпены[(CH3)2C=CH-(CH2)2-C(CH3)=CH-(CH2)2-C(CH3)=CH-CH2-]2 сквален – тетратерпенНатуральный каучук (цис-полиизопрен) и гуттаперча (транс-полиизопрен)лимонен](/img/tmb/12/1199505/402b3d65984df9d8be10ff27b6b1edb4-720x.jpg)
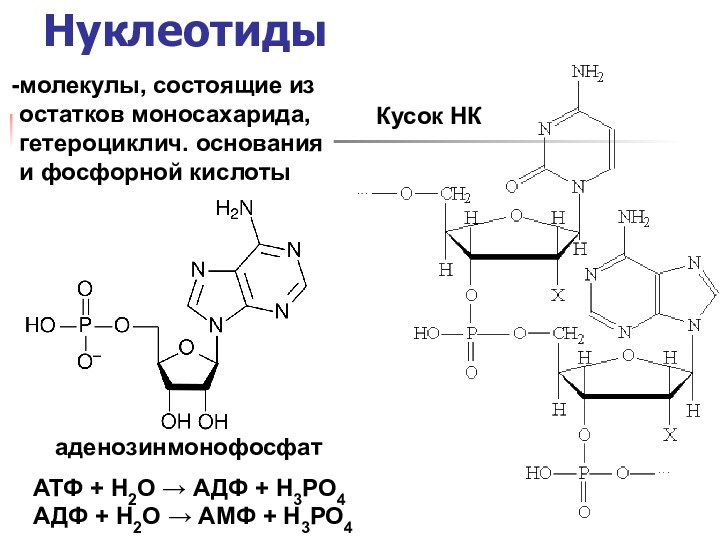
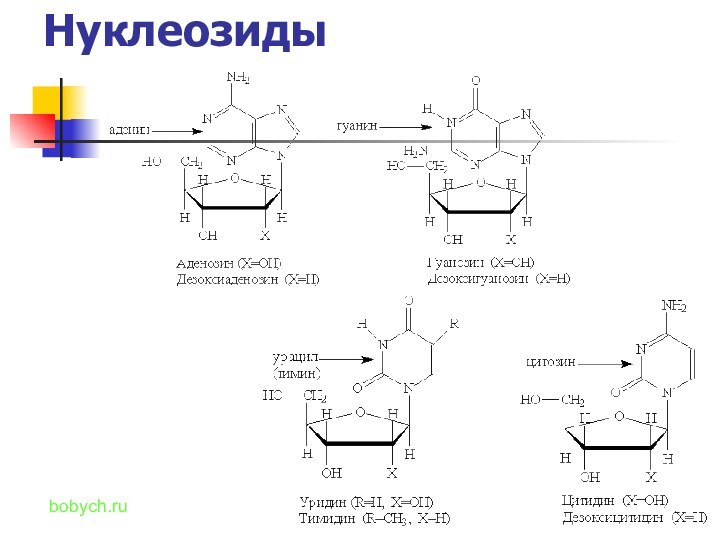
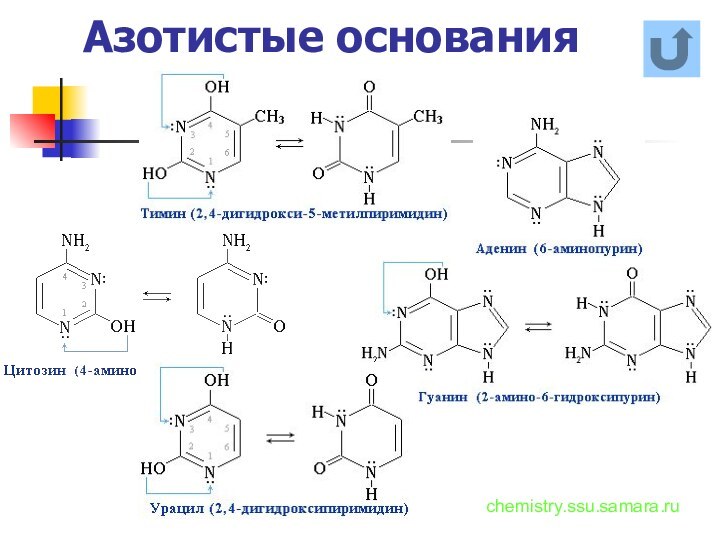
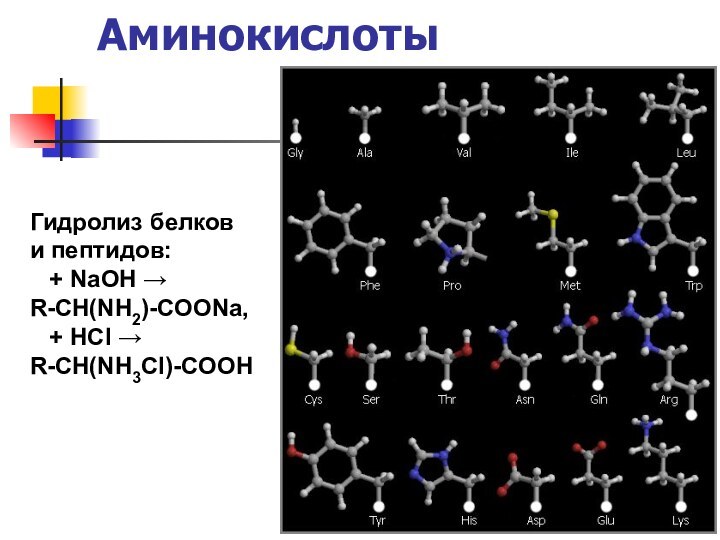
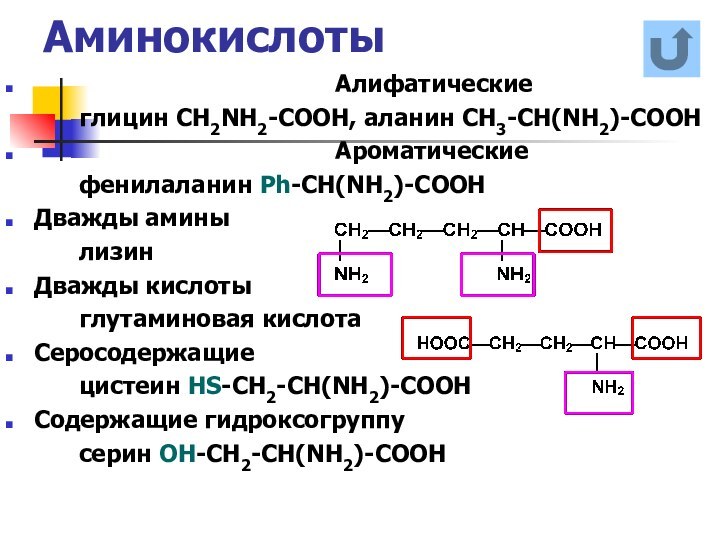
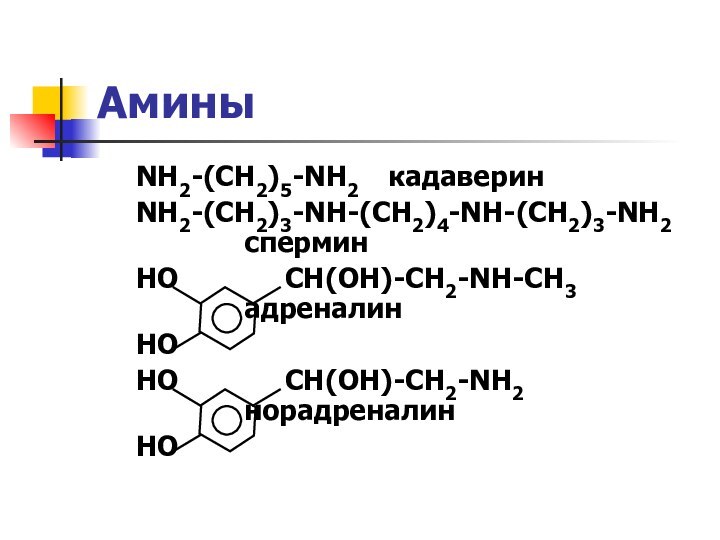
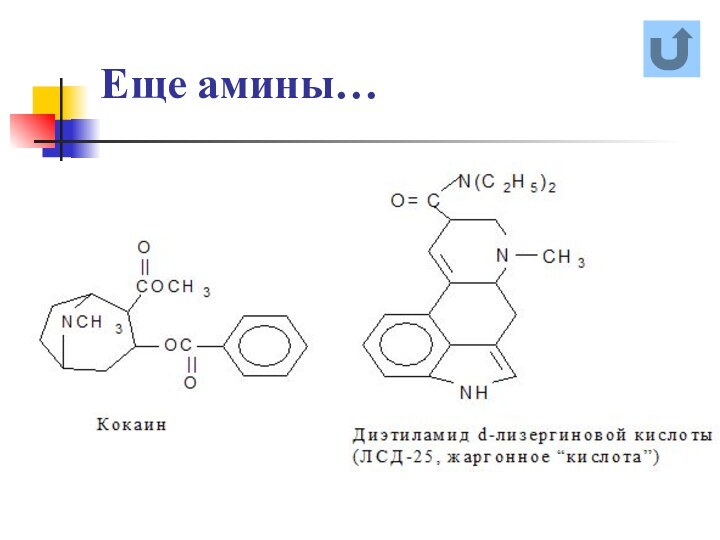
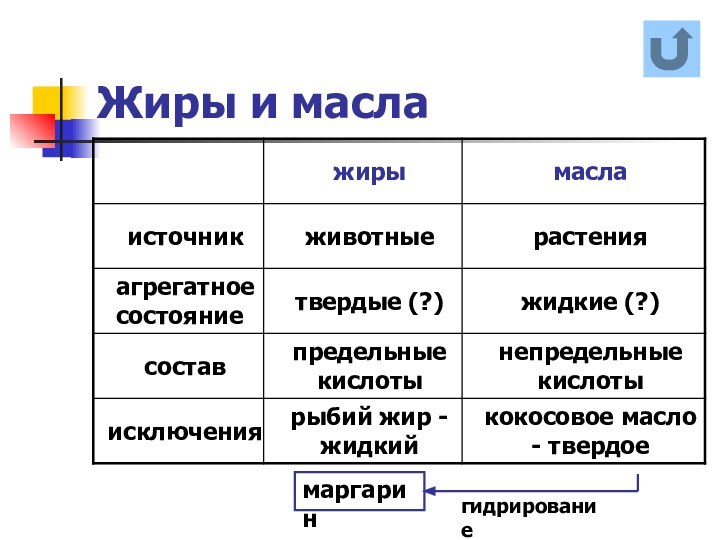
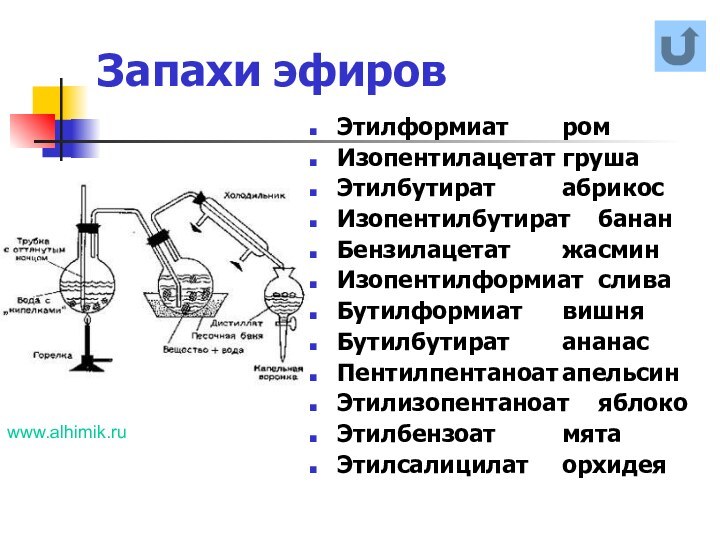
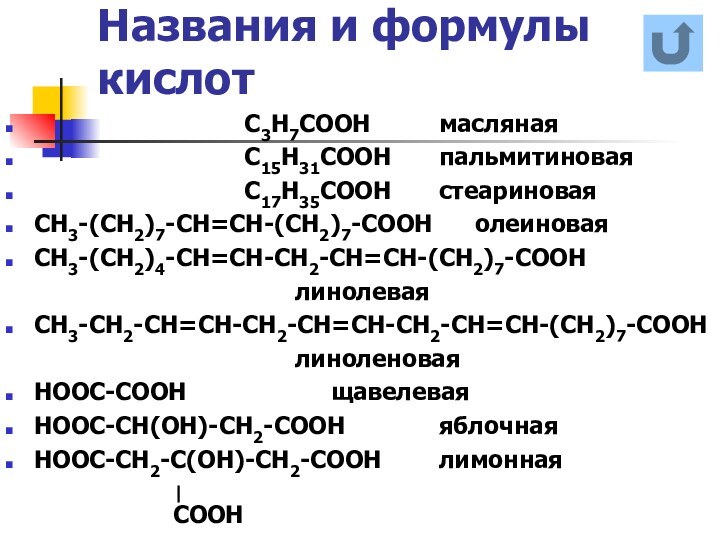


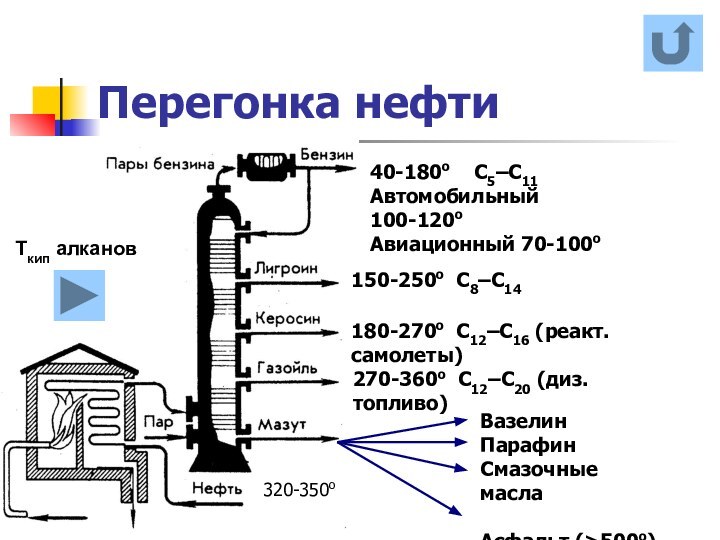
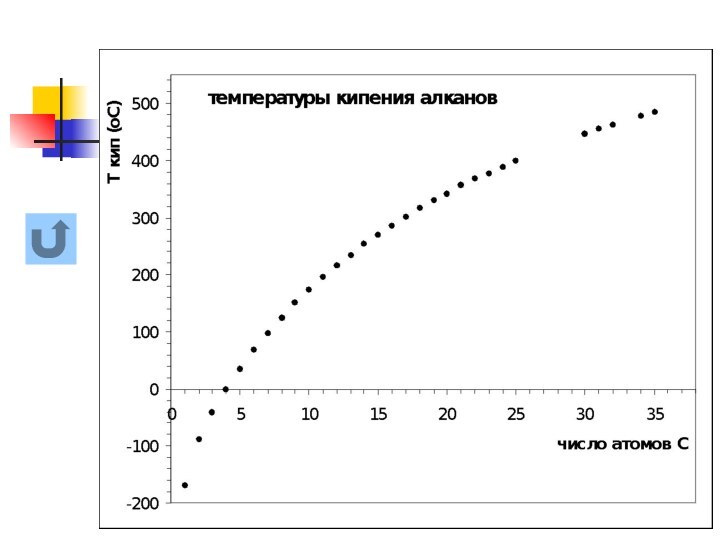




названия и формулы кислот
СООН
блок
каталитического
крекинга
ngfr.ru