Слайд 2
Распределение молекул газа по скоростям.
Пусть масса каждой
молекулы равна m и газ находится при температуре T.
Тогда получим произведение квадратичной функции v и экспоненты:
где k - постоянная Больцмана. Вид функции фактически определяется соотношение кинетической энергии молекулы к ее тепловой энергии кТ. Скорость, соответствующая максимуму функции F(v), называется наиболее вероятной скоростью vвер. Ее можно найти, приравняв нулю производную по v выражения F(v).
Слайд 3
Распределение Максвелла
На рисунке приведены и две другие
характерные скорости молекул: средняя арифметическая vср (среднее значение скорости
по молекулам) и средняя квадратичная vср.кв.
Величины данных скоростей близки (vср и vср.кв соотносятся с vвер как 1.13:1 и 1.22:1) но их надо различать. vср.кв как мы помним еще с предыдущей лекции определяет кинетическую энергию и давление. С помощью F(v) можно найти долю молекул от общего их числа N, скорости в интервале от v до v +d v :
Слайд 4
Распределение Максвелла
Проинтегрировав это выражение от v1 до
v2 , найдем долю М, со скоростями в любом
интервале скоростей.
При F → 0 то v →0 и при v →∞ (границы нет!) F → 0
Т.е. может достигать и 1-й (7.93 км/c) и 2-й (11.2) и 3-й (16.7) и атмосфера, например, может рассеиваться, а молекулы, достигшие 3-й космической скорости с ненулевой вероятностью возможно даже могу покинуть солнечную систему? Скорее всего нет! Мы пока не учитываем силу тяжести!
ехр х на квадратичную функцию => ассиметрична
При росте Т положение максимума распределения vвер сдвигается вправо, а величина максимума уменьшается. Площадь под кривой =const
При увеличении m вся кривая «уходит» влево
Распределение Максвелла подтверждено многими экспериментами, например, Штерном в 1920 г. На опыте с молекулярными пучками
Слайд 5
Распределение Максвелла
Если имеем смесь газов, находящуюся в
равновесном состоянии, например, воздух, то для каждого сорта молекул
есть распределение F(v) со своей массой молекул m. В результате более тяжелые молекулы будут двигаться, в среднем, с меньшей скоростью. Например, М водорода двигаются в 4 раза быстрее М кислорода, так как масса водорода в 16 раз меньше. При комнатной температуре средняя скорость молекул водорода около 1760 м/с.
Распределение Максвелла фактически является распределением Гаусса (нормальное распределение) . Это предельное распределение для суммы большого количества статистически независимых или слабо коррелированных событий. Например, малые флуктуации термодинамических величин около положения равновесия.
Посмотрим опыт с шариками. У них есть только одно направление т.е. только Vх =>все симметрично относительно 0.
Слайд 6
О распределении Максвелла для сыпучих тел
Если вы
хорошенько встряхнете коробку со стальными шариками, то их распределение
скоростей окажется таким же, как у идеального газа. Как и в кинетической теории газов, оно не будет зависеть от того, с какой скоростью и амплитудой вы трясете коробку. Математическое выражение для распределения скоростей стальных шариков, подбрасываемых в коробке – подобно формуле для молекул идеального газа, которая зависит только от средней скорости частиц, а не от плотности или того, каким образом трясли коробку. Но трясти надо сильно, чтобы шарики забыли о силе тяжести.
Слайд 7
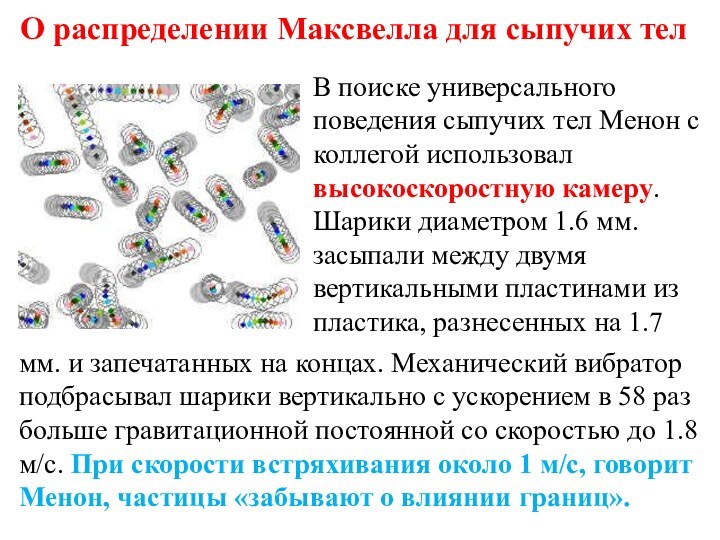
О распределении Максвелла для сыпучих тел
В поиске универсального
поведения сыпучих тел Менон с коллегой использовал высокоскоростную камеру.
Шарики диаметром 1.6 мм. засыпали между двумя вертикальными пластинами из пластика, разнесенных на 1.7
мм. и запечатанных на концах. Механический вибратор подбрасывал шарики вертикально с ускорением в 58 раз больше гравитационной постоянной со скоростью до 1.8 м/с. При скорости встряхивания около 1 м/с, говорит Менон, частицы «забывают о влиянии границ».
Слайд 8
Барометрическая формула
Ранее мы полагали , что внешних сил
нет. Т.е. существуют только хаотическое движение молекул, что и
приводило к равномерному распределению в занимаемом объеме. С точностью до флуктуаций в каждой единице объема содержалось одинаковое число молекул.
Если внешние силы существуют то => может быть неоднородное распределение.
Например , в поле силы тяжести с одной стороны все молекулы из-за стремления иметь min потенциальной энергии хотят сконцентрироваться внизу , а с другой тепловое движение пытается распределить их равномерно.
Слайд 9
Барометрическая формула
Рассмотрим вертикальный столб газа в поле сил
тяготения Земли. В тонком горизонтальном слое от h до
h+dh плотность газа ρ можно считать постоянной. Разность давлений p и p+dp определяется весом газа в слое dh :
Зная из практики, что с возрастанием высоты (при dh>0) давление уменьшается (dp<0):
Плотность газа ρ=М/V найдем из уравнения Клапейрона -Менделеева:
Слайд 10
Барометрическая формула
Подставив это выражение в форулу для dp
получим:
Проинтегрируем это выражение в предположении, что температура от высоты
не зависит (T=const ?):
Константу интегрирования найдем из начальных условий: при h=0 давление p=p0 и с=lnp0.
Слайд 11
Барометрическая формула
Таким образом получаем выражение:
Это выражение называется барометрической
формулой. При этом мы учли, что :
Для реальной земной
атмосферы эта формула приблизительна. И не только потому, что температура зависит от высоты, но и потому, что атмосферный воздух не находится в равновесии, происходит непрерывное перемешивание слоев.
Слайд 12
Барометрическая формула
Выражение дает распределение молекул идеального газа в
поле тяготения Земли в изотермической атмосфере.
С высотой изменяется g
. T.е. если хотим использовать для реальной атмосферы, то только на небольших высотах. Обычно для тропосферы около 11 км.
T≠const при увеличении h
Газ не идеальный и уравнение К-М использовать нельзя
Перемешивание столбов воздуха и внутри столба
Концентрация тяжелых молекул спадает быстрее и…..кислорода в горах маловато
Слайд 13
Барометрическая формула
При стремлении температуры к абсолютному нулю
все молекулы стремятся расположиться на поверхности Земли за счет
силового поля тяготения. T→0 n→0 все замерзнет и ляжет на Землю
При повышении температуры тепловое движение, характеризуемое энергией kT, стремится распределить молекулы равномерно по всем высотам. T→∞ n→n0 т.е. все будет распределено равномерно (∞ тепловая энергия) и молекулы забудут от гравитации (фактически получим случай, описываемый распределением Максвелла)
Реальное распределение представляет собой баланс этих двух тенденций.
Слайд 14
Хорошим игрокам законы физики мешают
Выяснилось, почему футболисты на

ЧМ-2010 бьют мимо ворот
Если раньше футболист, бьющий мимо ворот,
совершенно справедливо получал от болельщиков только отборную порцию мата, то теперь ученые решили вступиться за игроков сборных команд, сражающихся на чемпионате мира в ЮАР, показав, что дело здесь может быть не только в игроке.
Правда, пожалели они лишь тех мастеров кожаного мяча, что играют на стадионах Йоханнесбурга «Соккер Сити» и «Кока-Кола парк». Как оказалось, забивать мячи на них футболистам мешают непреложные физические законы.
Дело в том, что южноафриканский город Йоханнесбург расположен достаточно высоко над уровнем моря — на высоте 1680 м, и здесь аэродинамические свойства мяча оказываются иными, чем в более низких районах, из-за меньшей плотности воздуха. Футбольный снаряд куда сложнее закручивать. Кроме того, он летит быстрее. К этому выводу пришел аэрокосмический инженер NASA Раби Мехта, который заметил, что футболисты частенько совершают эффектные рывки к воротам противника, а потом ни с того ни с сего палят в небеса.
Слайд 15
Распределение Больцмана 1844-1860
Фактически мы рассмотрели только частный случай
поведения газа в поле силы тяжести. Каких-либо оснований считать,
что характер поведение частиц изменится, если вместо силы тяжести на них будет действовать какая-либо другая сила с такой же потенциальной энергией Епот, нет. Больцман доказал, что это данная формула описывает распределение любых одинаковых частиц в потенциальном силовом поле любой природы. Оно получило название распределение Больцмана.
Слайд 16
Факультативно: Распределение Максвелла-Больцмана
По Максвеллу нет зависимости от внешних
сил. По Больцману от распределения скоростей и => Максвелла-Больцмана.
Частным случаем (если Епот=0) является распределение Максвелла. Коэффициент перед экспонентой как и ранее определяется из условия, что суммарное число частиц по всем состоянием равно полному числу частиц в системе N.
Это предельный случай статистик Бозе -Эйнштейна (с целочисленным спином в ед. ћ) и Ферми-Дирака (с полуцелым спином ) распределений если пренебречь квантовым вырождением газа.
Атмосферы планет рассеиваются . У Луны уже нет. На Марсе сильно разрежена. У Венеры пока еще плотная. Покидают молекулы со 2-й косм. скорость но уже менее 11.2 км/c? Земля?
Слайд 17
На каком этаже жить здоровее?
В состав атмосферы, как
известно, входят газы, без которых человек не смог бы
выжить: это азот (78,08%), кислород (20,9%), аргон (0,93%) и углекислый газ (0, 031). Однако в мегаполисе нам отравляют жизнь еще 0,059% - продукты нашей же жизнедеятельности: бенз(а)пирен С20Н12, формальдегид С6Н5ОН, метилмеркаптан СН3SН, сероуглерод СS2, сажа белая SiO2*H2O, диоксид SO2 и оксиды железа Fe2O3, FeO, свинца PbO, углерода СО, азота NO.
На уровне Земли отношение концентраций постоянных газов к загрязнениям при температуре 20°С приблизительно равно 1700.
Слайд 18
На каком этаже жить?
Используем барометрическую формулу, которая определяет
зависимость давления или плотности газа от высоты в поле
тяжести, чтобы определить изменение этого соотношения с высотой:
где p=nkT, тогда
Слайд 19
На каком этаже жить?
Зная молярные массы всех газов,
рассчитаем отношение концентраций на высоте 50 м:
Таким образом, на
высоте 50 метров соотношение концентрации постоянных и вредных газов увеличивается: от 1700 на поверхности до 2060 на высоте 50 м. Напрашивается вывод: с увеличением массы молекул газа m все быстрее уменьшается концентрация данного газа с высотой. То же происходит при уменьшении температуры. Поэтому зимой на определенной высоте концентрация вредных газов должна быть меньше, чем летом.
Слайд 20
Микро и нано загрязнения
Частицы больше микрона (1/50 толщины
волоса) оседают на поверхности и удаляются при уборке. Их
число повышается когда в офисе работают люди – это отмершие клетки.
Наночастицы висят в воздухе месяцами и проникают в самые тонкие бронхиолы и их число в начале близко к значениям на улице а потом……воздух возле принтера в 10 грязнее в среднем по офису и как результат воздух во время работы лазерного принтера во всем офисе может быть до 4 раз грязнее уличного.
Держитесь подальше от больших офисных ксероксов и принтеров! Наночастицы совершают броуновское движение в воздухе!
Слайд 21
Термодинамика
Термодинамика первоначально возникла как наука о закономерностях
превращения тепла в работу при помощи тепловых машин и
основана на обобщении опытных фактов о макроскопических свойствах. Круг вопросов, которые она изучает, связан с тепловой формой движения материи, то есть с хаотическим движением атомов и молекул.
В настоящий момент термодинамика изучает также процессы передачи и переноса тепла и не только в идеальных газах , а и в магнитных материалах, сегнетоэлектриках и т.д.
Этот круг вопросов занимает в физике особое положение, связанное с тем, что любой вид энергии в процессе превращений может пройти через многие формы энергии, но конечным результатом всех превращений обязательно будет тепловая энергия . В тепло переходит механическая энергия (из-за трения), энергия электрического тока, энергия света, энергия химических превращений и ядерная энергия.
Слайд 22
Термодинамическое равновесие
Система находится в термодинамическом равновесии,
если макроскопические величины, определяющие ее состояние, остаются постоянными.
Например,
давление и температура.
Термодинамическое равновесие отличается от механического тем, что хотя макроскопические величины, характеризующие систему, остаются постоянными, частицы системы (атомы и молекулы) не прекращают своих сложных движений. Постоянство макроскопических параметров обусловлено громадным числом этих частиц.
Слайд 23
Равновесные процессы
Всякий переход системы из одного состояния
в другое (термодинамический процесс) связан с нарушением равновесия. Но
если переход совершать предельно медленно, то состояние системы в каждый момент времени будет равновесным. При этом скорость перехода надо каждый раз подбирать экспериментально.
Например, если газ под поршнем быстро сжать, то он окажется в неравновесном состоянии. Но если сжимать очень медленно, то газ в каждый момент времени будет иметь определенное давление, которое мало отличается в разных точках от своего среднего значения.
Процесс, состоящий из непрерывной последовательности равновесных состояний, называется равновесным или квазиравновесным
Близкие термины: стабильное – метастабильное, стационарное – квазистационарное.
Слайд 24
Энергия системы
Полная энергия системы складывается из кинетической энергии
системы Ек (если скорость центра масс системы как целого
не равна 0) + потенциальной энергии системы во внешнем поле сил Еп + внутренней энергии U системы.
Термодинамика имеет дело с внутренней энергией U, которая обладает той особенностью, что в термодинамические формулы входит не величина U, а ее изменение или производная по какому-либо параметру. Поэтому внутреннюю энергию можно определять с точностью до произвольной постоянной.
В реальных газах величина U включает в себя кинетическую энергию хаотического (теплового) движения молекул + взаимную потенциальную энергию, зависящую от взаимного расположения молекул (зависит от расстояния). При этом, первый вклад зависит от Т , а второй от V.
Т.е. U включает потенциальную энергию взаимодействия между молекулами тела, а не их потенциальную энергию во внешнем поле сил (например, в поле сил тяжести).