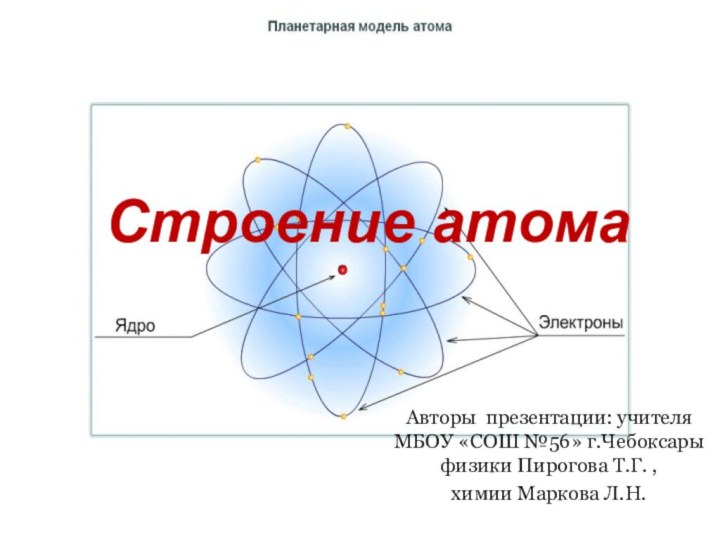
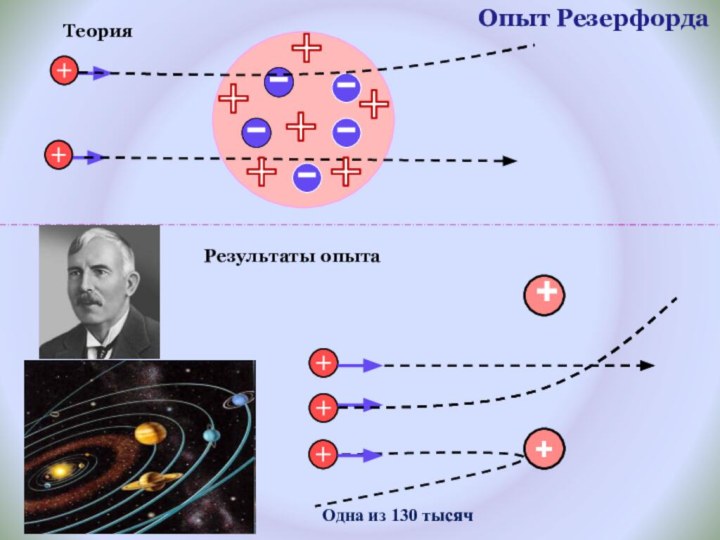
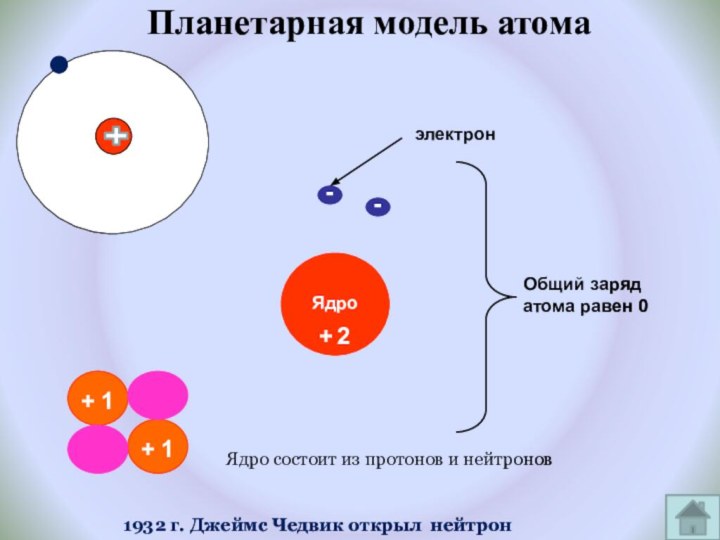
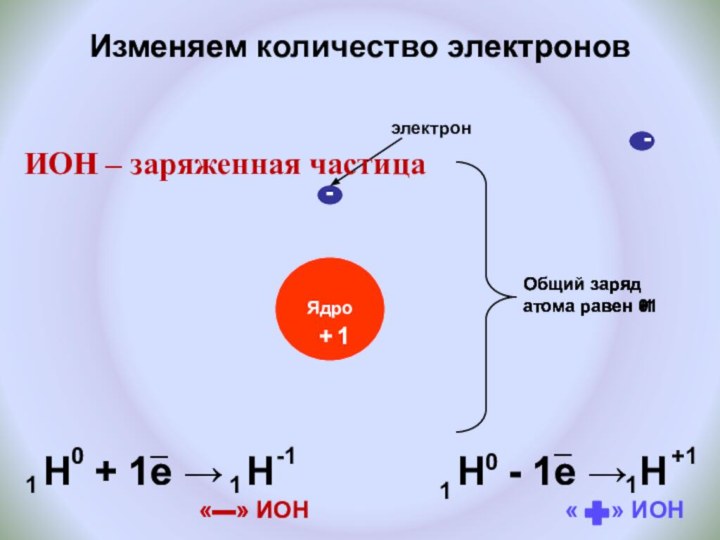
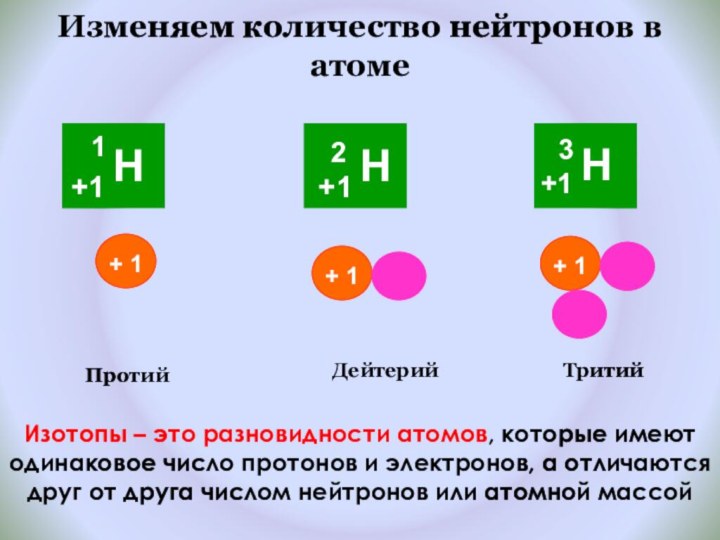
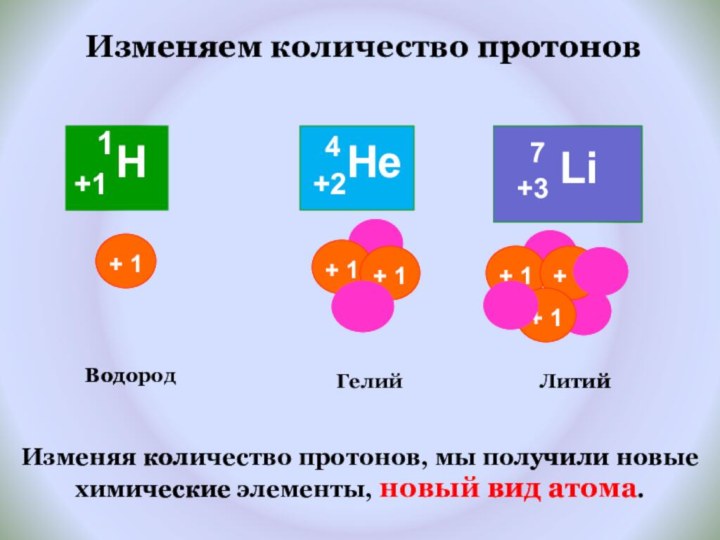
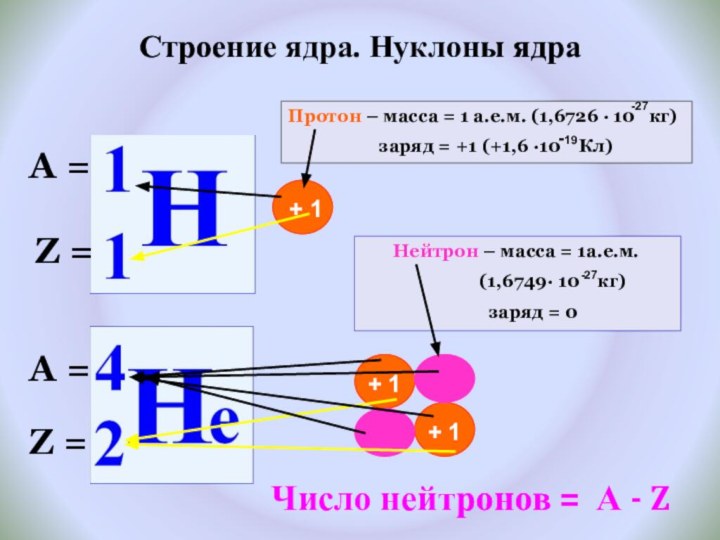
и показать единство законов физики и химии
Задачи:
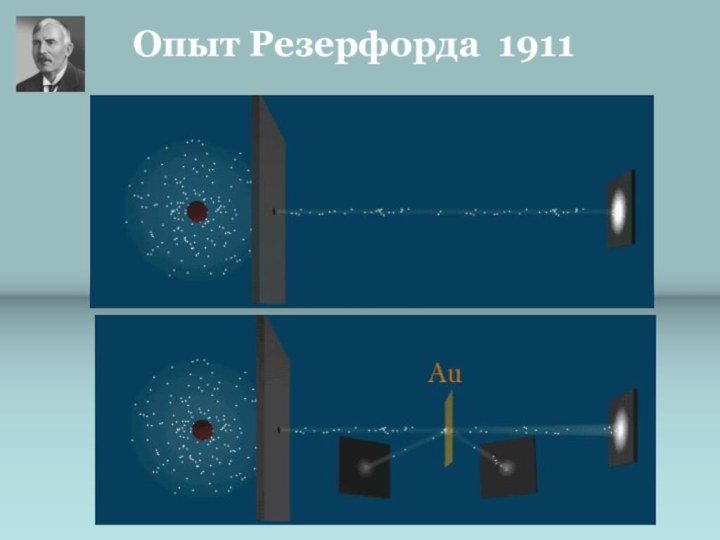
Познакомить с историческими
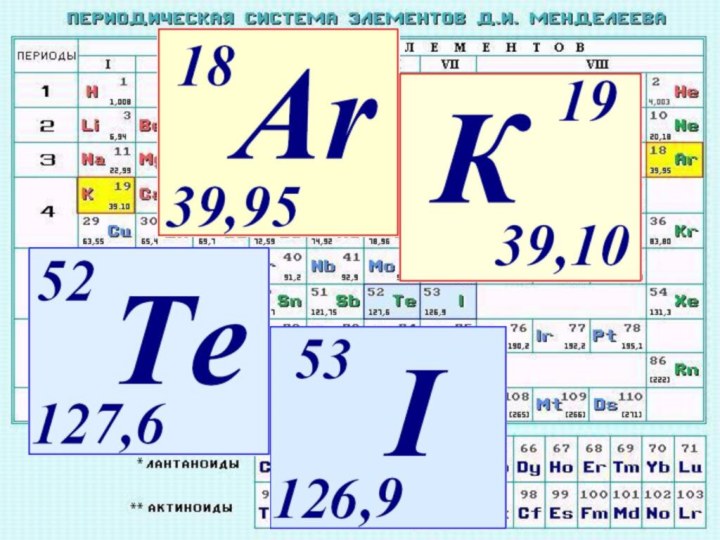
фактами открытия атома и его сложного строения.Показать, что заряд ядра является главной характеристикой химического элемента.
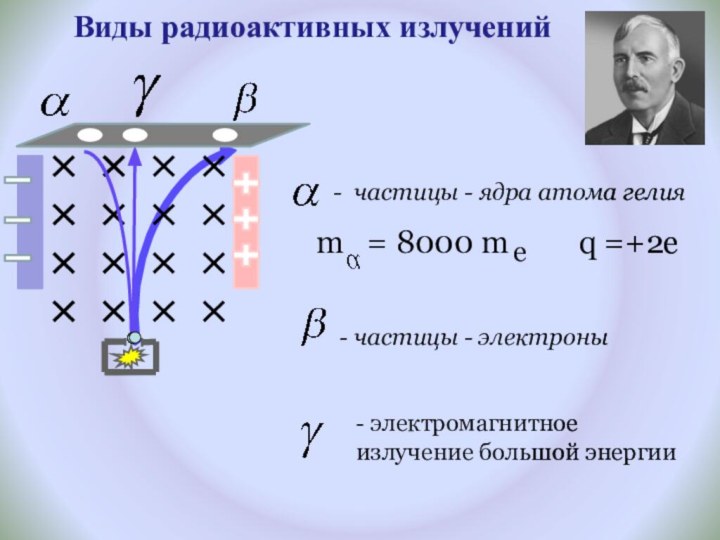
Рассмотреть факты, доказывающие сложное строение атома.