- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Поверхностные явления и адсорбция
Содержание
- 2. Поверхностные явления – совокупность явлений и процессов на границе раздела фаз, обусловленных свойствами поверхности.
- 3. Граница раздела фазРеальная или воображаемая область пространства,
- 4. Классификация поверхностей раздела
- 5. Поверхностный слой избыточная поверхностная энергияМолекулы, атомы, ионы,
- 6. Поверхностный слой избыточная поверхностная энергияизбыток энергии –
- 7. Поверхностный слой избыточная поверхностная энергиясамопроизвольные поверхностные явления с уменьшением поверхностной энергии (Δ Gs
- 8. Факторы, влияющие на адсорбцию.1)Температура; 2) Природа соприкасающихся
- 9. Подвижная граница разделаМерой адсорбции на подвижной границе
- 10. Подвижная граница раздела Отношение -dσ/dc называется поверхностной
- 11. Поверхностно-активные веществаВещества, понижающие поверхностное натяжение воды, называются поверхностно-активными веществами (ПАВ)
- 12. Поверхностно-активные вещества
- 13. Зависимости поверхностного натяжения растворов от концентрации1 –
- 14. Изотерма адсорбции ПАВ.
- 15. где М – молярная масса ПАВ, ρ-
- 16. . Адсорбция на неподвижной границе раздела
- 17. уравнение Ленгмюра
- 18. Нахождение численных значений констант в уравнении Лэнгмюра1/
- 19. Адсорбция сильных электролитов (ионная адсорбция).Чем выше заряд
- 20. избирательная адсорбция.В соответствии с правилом Панета-Фаянса: из
- 21. ХроматографияХроматография – физико-химический метод исследования, основанный на
- 22. Скачать презентацию
- 23. Похожие презентации
Поверхностные явления – совокупность явлений и процессов на границе раздела фаз, обусловленных свойствами поверхности.




















Слайд 2 Поверхностные явления – совокупность явлений и процессов на
границе раздела фаз, обусловленных свойствами поверхности.
Слайд 3
Граница раздела фаз
Реальная или воображаемая область пространства, пересечение
которой приводит к резкому изменению физических и химических свойств
Слайд 5
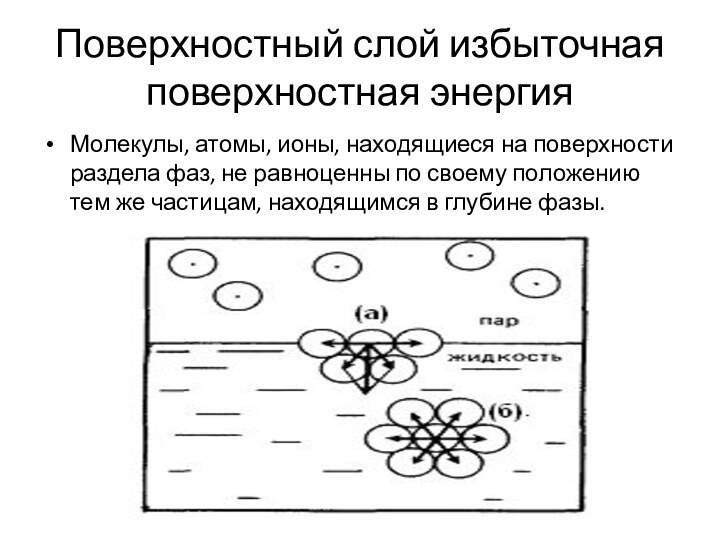
Поверхностный слой избыточная поверхностная энергия
Молекулы, атомы, ионы, находящиеся
на поверхности раздела фаз, не равноценны по своему положению
тем же частицам, находящимся в глубине фазы.
Слайд 6
Поверхностный слой избыточная поверхностная энергия
избыток энергии – поверхностная
энергия Гиббса (Gs) – термодинамическая функция, характеризующая энергию межмолекулярного
взаимодействия частиц на поверхности раздела с частицами каждой из граничащих фаз. Поверхностная энергия Гиббса пропорциональна площади поверхности раздела фаз (S):Gs = ∙ S
где - коэффициент поверхностного натяжения (удельная поверхностная энергия).
Слайд 7
Поверхностный слой избыточная поверхностная энергия
самопроизвольные поверхностные явления с
уменьшением поверхностной энергии (Δ Gs
поверхности раздела фаз (ΔS<0), что происходит при коалесценции (слиянии капель жидкости или пузырьков газа) и коагуляции (слипании частиц дисперсной фазы);за счет уменьшения поверхностного натяжения
(Δ <0), что наблюдается при сорбции (адсорбции).
Адсорбция – самопроизвольное перераспределение молекул компонента между объемом фазы и поверхностным слоем.
Слайд 8
Факторы, влияющие на адсорбцию.
1)Температура; 2) Природа соприкасающихся фаз;
3) Природа растворенного вещества 4) Концентрация
Правило Дюкло-Траубе: В гомологических
рядах адсорбция увеличивается в 3 – 3,5 раза (при малых концентрациях) на каждую группу СН2.
Слайд 9
Подвижная граница раздела
Мерой адсорбции на подвижной границе раздела
фаз служит величина адсорбции Г («гамма»), которая выражается количеством
(в моль) растворенного вещества, приходящимся на единицу площади поверхности; единицы измерения моль/м2.Связь между величиной адсорбции и коэффициентом поверхностного натяжения устанавливает уравнение Гиббса:
где ср – равновесная концентрация адсорбата в данном интервале концентраций; R – универсальная газовая постоянная 8,31 Нּм /(мольּК); Т – температура, К.
Слайд 10
Подвижная граница раздела
Отношение -dσ/dc называется поверхностной активностью
(обозначается g):
Поверхностная активность – это способность вещества изменять величину поверхностного натяжения.
Слайд 11
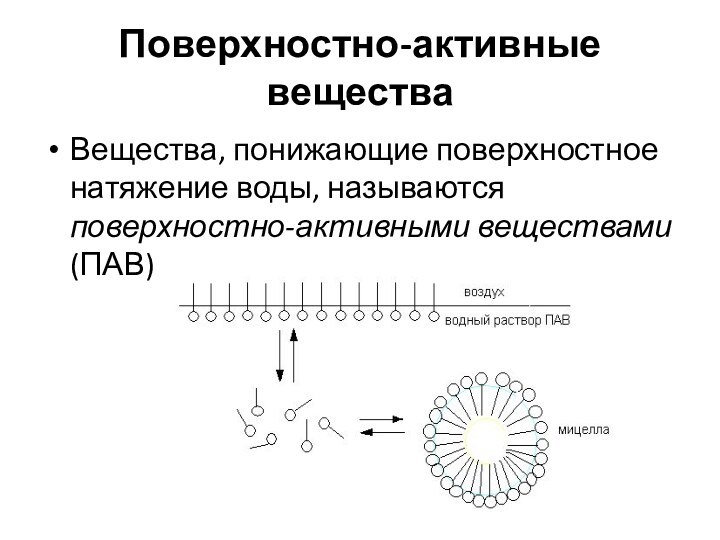
Поверхностно-активные вещества
Вещества, понижающие поверхностное натяжение воды, называются поверхностно-активными
веществами (ПАВ)
Слайд 13
Зависимости поверхностного натяжения растворов от концентрации
1 – поверхностно-активных
, 2 – поверхностно-инактивных и 3 – поверхностно-неактивных веществ.
Слайд 16
. Адсорбция на неподвижной границе раздела фаз
Изотерма
адсорбции. Адсорбция на подвижной границе (Г) и неподвижной границе
(а) количественно описывается уравнением Ленгмюра. Основные положения теории Ленгмюра:адсорбция происходит не на всей поверхности адсорбента, а только на активных центрах;
каждый центр удерживает только одну молекулу адсорбата, при чем адсорбированные молекулы не взаимодействуют со свободными молекулами.
Адсорбция – процесс обратимый. Процесс, обратный адсорбции называется десорбцией. Величина, равная отношению констант скоростей процессов десорбции и адсорбции, называется константа Ленгмюра (обозначается α)
Слайд 19
Адсорбция сильных электролитов (ионная адсорбция).
Чем выше заряд и
радиус иона, тем лучше он адсорбируется (исключение составляет ион
Н+).По способности к адсорбции ионы образуют лиотропные ряды:
Катионы: Na+
эквивалентная адсорбция;
обменная адсорбция;
избирательная адсорбция.