Слайд 2
Цели и задачи урока :
Рассмотреть воду как вещество
с точки зрения физики, химии, биологии, экологии;
показать значение воды
для жизни на Земле;
рассмотреть необходимость охраны природы .
Слайд 4
ВОДА
Девиз урока:
Вода – это жизнь!
Слайд 5
Вода- самое драгоценное минеральное сырьё ,это не только
средство для развития промышленности и сельского хозяйства ,вода-это действительный
проводник культуры ,это живая кровь, которая создаёт жизнь там, где её не было.
Академик Л.П.Карпинский
Слайд 10
№ 1
Вода в природе
Велики ли запасы воды на
нашей планете?
2. Чего больше на Земле — соленой
или пресной воды?
3. Где сосредоточены основные запасы пресной воды?
Слайд 12
Сколько воды
на нашей планете?
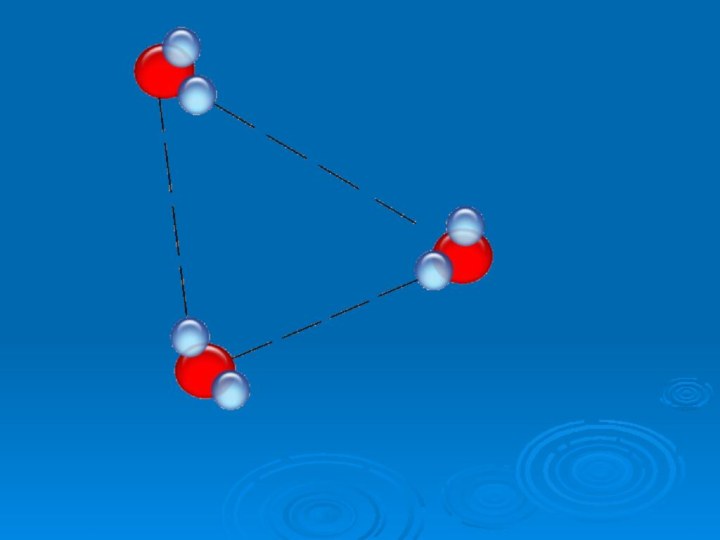
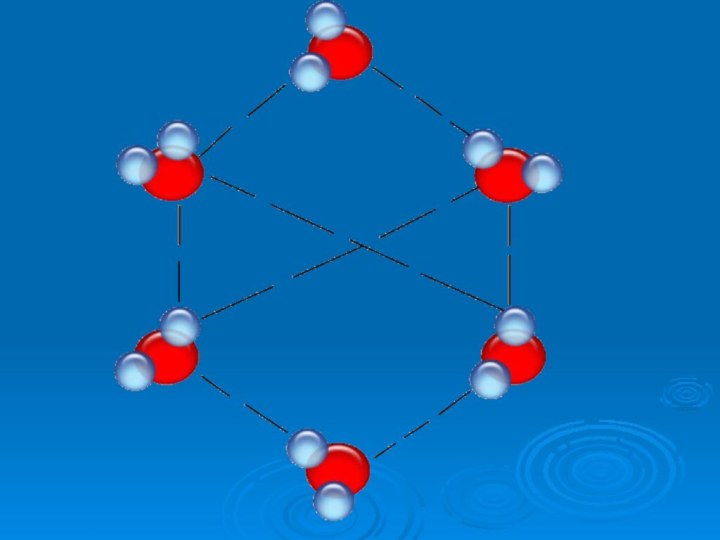
Общие мировые запасы воды
во всех её агрегатных состояниях огромны. Вода относится к
числу наиболее распространённых в природе веществ. Общее её количество составляет 1,4 ∙1018 т, она покрывает примерно 4/5 площади земной поверхности. Если бы разделить её поровну, то на каждого жителя планеты пришлось бы по
280 млрд л. Однако 97 % водных ресурсов приходится на долю океанов.
Слайд 13
№ 2
Значение воды для жизни организмов
1. Какова роль
воды в организме человека?
2. Зависит ли количество воды в
организме от возраста?
Слайд 15
№ 3
Вода — растворитель
Почему воду называют универсальным растворителем?
2.
Какой величиной характеризуется способность веществ растворяться в воде?
3. Растворимость
зависит от температуры?
Слайд 17
№ 4
Химики-экспериментаторы
Растворимость зависит от температуры?
От чего еще зависит
растворимость ?
Слайд 18
Особые свойства воды
Какое свойство воды спасает нашу планету
от оледенения?
2. При какой температуре у воды максимальная плотность?
3. К каким важным последствиям приводит эта аномалия?
Слайд 19
Химические свойства воды
Она необходима нам всегда.
И юный химик,
верно, пожелает
Узнать, с чем реагирует вода
И как она в
реакции вступает.
Слайд 20
Взаимодействие воды с простыми веществами
Опишет наша первая глава
Процессы
водорода замещения,
И как с водой простые вещества
Вступают в непростые
отношения.
Слайд 21
1. Реакции воды с металлами
Кусочек лития пинцетом взят.
Отметьте,
что условия обычны.
Опустим в воду — тут же результат:
Пошла
реакция, она экзотермична.
Вмиг из воды наш щелочной металл
Газ водород активно вытесняет,
А тот, ликуя, что свободным стал,
Шипит и литий по воде гоняет.
Кружит металл, как шаловливый пес,
Как будто за хвостом своим гоняясь,
Потерю электронов перенес,
С гидроксигруппой в щелочь превращаясь:
2 Li + 2 HOH = 2 LiOH + H2 + Q.
А индикатор проливает свет
На появленье оснований сильных:
Раствор в малиновый окрасив цвет,
Групп подтвердит наличие гидроксильных.
Слайд 22
2. Реакции воды с неметаллами
И неметаллы могут вытеснять
Газ
водород из водяного пара.
К примеру, угольки мы можем взять.
Но
предварительно задав им жару:
С + Н2О = СО + Н2.
Слайд 23
Взаимодействие воды со сложными веществами
Поговорим о сложных веществах.
С
оксидами сначала разберемся.
Причем практически, не на словах,
Взаимодействия с водой
коснемся.
Слайд 24
1. Реакции воды с основными оксидами
К оксиду кальция
воды прилить –
Вмиг в гидроксид случится превращение.
Так мы «пушонку»
можем получить,
Ведь происходит извести гашение:
СаО + Н2O = Са(ОН)2 + Q.
Слайд 25
В природе есть железная руда,
Железняки — основные оксиды.
Так
вот, не растворяет их вода.
Но мы не держим на
нее обиды:
Fe2O3 + H2O =
Fe3O4 + H2O =
Оксид железа(II, III) – магнитный железняк, оксид железа(III) – красный железняк.
Слайд 26
2. Реакции воды с
кислотными оксидами
Нам так приятен
летнею порой
Вкус кислый газированной водицы!
А обусловлен он, представьте, кислотой,
И
знать реакцию вам пригодится.
Оксид кислотный — углекислый газ —
С водой соединяется охотно.
Хоть воду эту пили мы не раз,
Не думали, что пьем раствор кислотный:
CO2 + H2O = H2CO3.
Слайд 27
А под ногами нашими песок —
Оксид кислотный.
Только он
едва ли
С водой соединиться мог,
Не то бы мы по
кислоте шагали:
Н2О + SiO2 =
Слайд 28
Так как же общий вывод прозвучит?
У вас уже
есть опыт ощутимый:
С водой соединяется оксид,
Когда продукт реакций —
растворимый.