Слайд 2
ХИМИЧЕСКИЙ АНАЛИЗ
Большинство анализируемых веществ находятся в
материале – искусственных или естественных смесях нескольких соединений.
Поэтому часто
возникает необходимость предварительного разделения смеси на отдельные составляющие.
Совокупность действий, в результате которых мы можем получить информацию об объекте исследования
Слайд 3
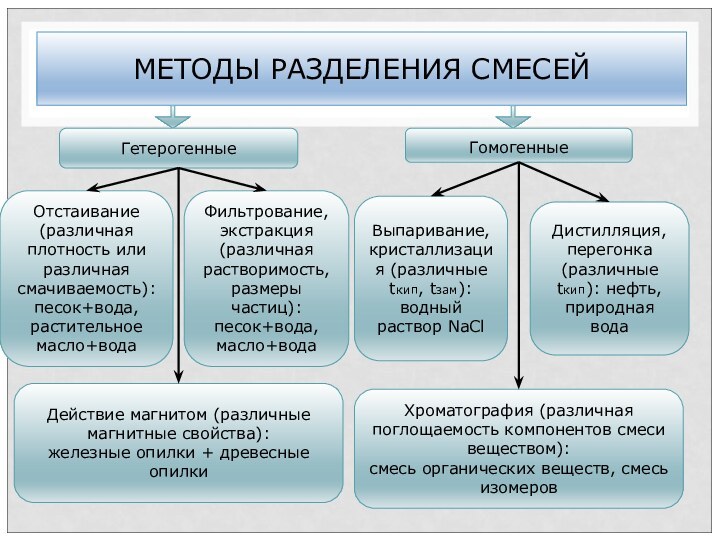
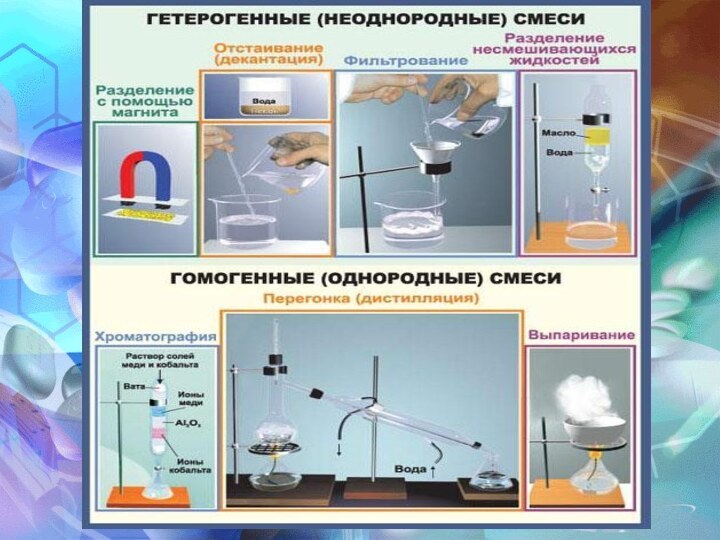
МЕТОДЫ РАЗДЕЛЕНИЯ СМЕСЕЙ
Гомогенные
Гетерогенные
Отстаивание (различная плотность или
различная смачиваемость): песок+вода,
растительное масло+вода
Фильтрование, экстракция (различная растворимость, размеры
частиц):
песок+вода,
масло+вода
Выпаривание, кристаллизация (различные tкип, tзам): водный раствор NaCl
Дистилляция, перегонка (различные tкип): нефть, природная вода
Действие магнитом (различные магнитные свойства):
железные опилки + древесные опилки
Хроматография (различная поглощаемость компонентов смеси веществом):
смесь органических веществ, смесь изомеров
Слайд 5
РАСТВОРЕНИЕ ТРЕТЬЕГО ВЕЩЕСТВА
Если в систему, состоящую из двух
несмешивающихся жидкостей ввести третье вещество, способное растворяться в каждой
из этих жидкостей, то растворенное вещество будет распределяться между обеими жидкостями пропорционально своей растворимости в каждой из них
Слайд 6
ЗАКОН РАСПРЕДЕЛЕНИЯ
Вещество способное растворяться в двух несмешивающихся растворителях,
распределяется между ними так, что отношение его концентраций в
этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества:
К – коэффициент распределения,
С1 и С2– концентрации растворенного вещества в первом и втором растворителях
Слайд 7
ПРИМЕР
К I2 = 130 между водой и хлороформом.
Если
к воде, содержащей растворенный йод, добавить не смешивающийся с
ней хлороформ, взболтать эту систему и дать ей отстояться, то после установления равновесия концентрация йода в хлороформе окажется в 130 раз больше, чем в воде независимо от общего количества растворенного йода
Слайд 8
ПРИМЕР
Таким образом с помощью хлороформа можно извлечь (экстрагировать)
из воды преобладающую часть растворенного в ней йода.
Экстракция широко
применяется в лабораторной практике и в промышленности
Слайд 9
ЭКСТРАКЦИЯ
Экстра́кция (от лат. extraho — извлекаю) — метод извлечения вещества) — метод извлечения вещества из раствора) — метод извлечения вещества из раствора или
сухой смеси с помощью подходящего растворителя (экстраге́нта).
Для извлечения из смеси
применяются растворители, не смешивающиеся с этой смесью.
Экстракция может быть разовой (однократной или многократной) или непрерывной (перколя́ция).
Простейший способ экстракции из раствора — однократная или многократная промывка экстрагентом в делительной воронке.
Слайд 10
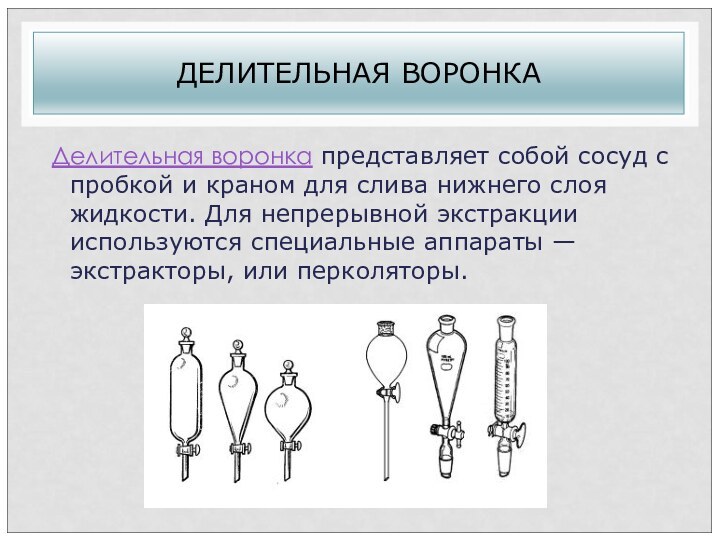
ДЕЛИТЕЛЬНАЯ ВОРОНКА
Делительная воронка представляет собой сосуд с пробкой и
краном для слива нижнего слоя жидкости. Для непрерывной экстракции
используются специальные аппараты — экстракторы, или перколяторы.
Слайд 11
МЕХАНИЗМ ЭКСТРАКЦИИ
Жидкостная экстракция предполагает перенос одного (или больше) растворимых
веществ, содержащихся в подаваемом растворе, в другую несмешиваемую жидкость (экстрагент).
Экстрагент, обогащенный растворимыми веществами, называется экстракт. Остаток исходного раствора без растворимых веществ называется рафинат.
Исходный раствор и экстрагент контактируют друг с другом для того, чтобы осуществился перенос растворимых веществ. Две выходящие жидкие фазы, экстракт и рафинат, разделяются статической декантацией (смеситель-отстойник) или центробежной декантацией (центробежные экстракторы).
Слайд 12
ТРИ СТАДИИ ЭКСТРАКЦИИ
смешение исходной смеси веществ с экстрагентом;
механическое разделение (расслаивание) двух образующихся фаз;
удаление экстрагента из обеих фаз и его регенерацию с целью повторного использования.
После механического разделения получают раствор извлекаемого вещества в экстрагенте (экстракт) и остаток исходного раствора (рафинат) или твёрдого вещества.
Выделение экстрагированного вещества из экстракта и одновременно регенерация экстрагента производится дистилляцией , выпариванием, кристаллизацией,
высаливанием и т. п.
Слайд 13
МАСКИРОВАНИЕ
Маскирование – это перевод мешающих компонентов в такую
форму, которая уже не оказывает мешающего влияния.
Этот процесс
можно рассматривать как торможение или полное подавление химической реакции в присутствии веществ, способных изменить ее направление или скорость.
При этом не происходит образования новой фазы, в чем и состоит основное преимущество маскирования перед разделением, поскольку исключаются операции, связанные с отделением фаз друг от друга.
Слайд 14
ВИДЫ МАСКИРОВАНИЯ
Различают два вида маскирования – термодинамическое (равновесное)
и кинетическое (неравновесное):
При термодинамическом маскировании создают условия, при которых
условная константа реакции понижается до такой степени, что реакция идет незначительно. Концентрация маскируемого компонента становится недостаточной для того, чтобы надежно зафиксировать аналитический сигнал.
Кинетическое маскирование основано на увеличении разницы между скоростями реакции маскируемого и определяемого веществ с одним и тем же реагентом. Например, индуцированная реакция MnO-4 с Cl- в присутствии Fe (II) замедляется, если добавлены фосфат-ионы.
Слайд 15
ПРИМЕРЫ
Для маскировки широко применяются органические кислоты (лимоннаяДля маскировки
широко применяются органические кислоты (лимонная, виннаяДля маскировки широко применяются органические
кислоты (лимонная, винная, уксусная,
щавелеваящавелевая и др.), комплексоныщавелевая и др.), комплексоны, а также неорганические соединения, например, фториды, цианиды и др.
ЖелезоЖелезо (III) мешает определению никеляЖелезо (III) мешает определению никеля (II) при осаждении диметилглиоксимом, так как катион Fe3+ в интервале pH 5-10, характерном для протекания реакции, образует темно-коричневый гидроксид Fe2O3·nH2O.
Если в раствор ввести винную кислоту, образующую с железом (III) мало диссоциирующий растворимый комплекс, то оно не будет осаждаться и мешать определению никеля.
Если в раствор ввести фторид натрияЕсли в раствор ввести фторид натрия или фторид аммония, то образуется устойчивый бесцветный комплекс FeF52−, который маскирует катион Fe3+
Слайд 16
ГРУППЫ МАСКИРУЮЩИХ ВЕЩЕСТВ
Вещества, образующие с мешающими веществами более

устойчивые соединения, чем с определяемыми. Например, образование комплекса Fe
(III) с тиоцианат-ионом красного цвета можно предотвратить введением в раствор фторида натрия. Фторид-ионы связывают Fe (III) в бесцветный комплекс [FeF6]3-, более устойчивый, чем [Fe(SCN)nn-3],что позволяет устранить мешающее влияние Fe (III) при обнаружении, например,
Со (II) в виде комплекса синего цвета [Co(SCN)n] n-2.
Вещества, предотвращающие кислотно-основные реакции с образование малорастворимых гидроксидов. Например, в присутствии винной кислоты Fe(OH)3 нe осаждается аммиаком вплоть до pH 9-10.
Вещества, изменяющие степень окисления мешающего иона. Например, для устранения мешающего влияния Cr (III) при комплексонометрическом титровании алюминия и железа рекомендуется его окислить до Cr (VI).
Вещества, осаждающие мешающие ионы, но осадок при этом можно не отделять. Например, при комплексонометрическом титровании кальция в присутствии магния, который осаждают в виде гидроксида, но не отделяют. Иногда маскирование сочетает указанные приемы.
Слайд 17
ЭФФЕКТИВНОСТЬ МАСКИРОВАНИЯ
Для оценки эффективности маскирования пользуются индексом маскирования.
Это логарифм отношения общей концентрации мешающего вещества к его
концентрации, оставшейся не связанной.
Слайд 18
СООСАЖДЕНИЕ
Соосаждение – это переход в осадок присутствующих в
растворе посторонних веществ, которые в данных условиях должны оставаться
в растворе; другими словами, при соосаждении происходит захват примесей из ненасыщенного раствора.
Например, осадок BaSО4, полученный при добавлении ВаС12 к раствору Na2SО4, содержит примеси ионов, входящих в состав и осадителя и осаждаемого вещества.
Соосаждение происходит в процессе образования осадка, а не после его образования. Так, осаждая BaSО4 из растворов, содержащих МnО4- получают осадок розового или фиолетового цвета из-за соосаждения. Однако, если взять готовый препарат BaSО4 и взбалтывать его с раствором КМnO4, соосаждения не происходит, осадок остается неокрашенным.
Слайд 19
ВИДЫ СООСАЖДЕНИЯ
По механизму захвата посторонних веществ различают два
основных вида соосаждения: адсорбцию и окклюзию.
Адсорбция наиболее ярко выражена
в случае аморфных (мелкодисперсных) осадков, которые отличаются сильно развитой общей поверхностью.
При окклюзии посторонние ионы находятся внутри кристаллов осадка и более или менее равномерно распределяются по всему объему твердой фазы. Окклюзия характерна в основном для кристаллических осадков. В реальных условиях анализа один из типов соосаждения не присутствует в чистом виде, а только преобладает.
Слайд 20
МЕТОДЫ УСТРАНЕНИЯ СООСАЖДЕНИЯ
Методы устранения (или хотя бы уменьшения)
соосаждения зависят от его типа.
Так, окклюдированные примеси нельзя
отмыть, но их можно в значительной мере уменьшить в процессе осаждения.
Для этого осаждение рекомендуется вести в условиях, при которых растворимость трудно растворимой соли достигает максимума. Осадитель необходимо прибавлять медленно, интенсивно перемешивая раствор. В этих условиях происходит медленный рост небольшого количества крупных кристаллов. Кристаллические осадки осаждают из горячих кислых растворов (условия их максимального растворения).
Слайд 21
ПЕРЕОСАЖДЕНИЕ
Еще один прием борьбы с окклюдированными примесями –
переосаждение.
Осадок растворяют в подходящем растворителе (растворе кислоты и
т.п.) и снова осаждают. Так как основной причиной окклюзии является захват посторонних веществ в процессе роста, то ясно, что количество примесей в повторно осажденном осадке будет меньше.
Слайд 22
МЕТОДЫ УМЕНЬШЕНИЯ АДСОРБЦИИ
Для уменьшения адсорбции необходимо увеличение среднего
размера частиц, повышение температуры и промывание осадка промывными жидкостями.
При этом можно использовать обменную адсорбцию, заменив адсорбированную нелетучую примесь на летучую.
Например, при промывании осадка AgCl, загрязненного ионами Na+, азотной кислотой поверхность оказывается загрязненной летучей НС1.
Слайд 23
МЕТОДЫ УМЕНЬШЕНИЯ АДСОРБЦИИ
В случае аморфных осадков уменьшить содержание
примесей можно так.
Осаждение проводят из горячих концентрированных растворов,
а затем быстро разбавляют горячей водой. При этом образовавшийся осадок имеет не очень большую поверхность, а разбавление горячей водой приводит к отмывке захваченных поверхностью осадка примесей.
Слайд 24
СТАРЕНИЕ
Осадок очищается также за счет настаивания: кристаллический осадок
вместе с маточным раствором оставляют на какое-то время, в
течение которого происходят физико-химические процессы, называемые старением, созреванием осадка. В процессе старения происходит рекристаллизация первичных частиц, растворение мелких и рост крупных кристаллов, превращение осадка в устойчивую модификацию и т.д.
Слайд 25
КЛАССИФИКАЦИЯ ЭЛКТРОЛИТОВ
ЭЛЕКТРОЛИТЫ
СИЛЬНЫЕ
ПРАКТИЧЕСКИ ПОЛНОСТЬЮ ДИССОЦИИРУЮТ НА ИОНЫ
СОЛИ,
НЕКОТОРЫЕ НЕОРГАНИЧЕСКИЕ
КИСЛОТЫ
И ЩЕЛОЧИ
СЛАБЫЕ
ДИССОЦИИРУЮТ НА ИОНЫ
В НЕЗНАЧИТЕЛЬНОЙ СТЕПЕНИ
ОРГАНИЧЕСКИЕ КИСЛОТЫ,
МНОГИЕ НЕОРГАНИЧЕСКИЕ
КИСЛОТЫ, ТРУДНОРАСТВОРИМЫЕ ГИДРОКСИДЫ
HNO3, H2SO4,HClO4, HCl, HBr, HI,
KOH, NaOH, Ca(OH)2, Ba(OH)2
(гидроксиды 1, 2 группы таблицы Д.И. Менделеева)
H2CO3, H2S, H2SO3, H2SiO3, HCN, NH4OH, труднорастворимые гидроксиды металлов
3-8 группы таблицы
Д.И. Менделеева
Слайд 26
СТЕПЕНЬ ДИССОЦИАЦИИ
Слабые электролиты в водных растворах диссоциируют только
частично, и в растворе устанавливается динамическое равновесие между недиссоциированными
молекулами и ионами.
Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе
Где n – число диссоциированных молекул вещества, N – общее число растворенных молекул вещества
Понятие степени диссоциации к сильным электролитам практически не применимо, так как в водных растворах они диссоциированы практически нацело.
Слайд 27
ФАКТОРЫ ВЛИЯЮЩИЕ НА СТЕПЕНЬ ДИССОЦИАЦИИ
Степень диссоциации зависит от:
природы электролита
природы растворителя
концентрации раствора
температуры раствора
СТЕПЕНЬ ДИССОЦИАЦИИ
УВЕЛИЧИВАЕТСЯ ПО МЕРЕ ВОЗРАСТАНИЯ ТЕМПЕРАТУРЫ И РАЗБАВЛЕНИЯ РАСТВОРА
Слайд 28
ДИССОЦИАЦИЯ
МНОГООСНОВНЫХ КИСЛОТ
Многоосновные кислоты диссоциируют ступенчато.
Например: диссоциация угольной
кислоты происходит в две ступени
I. Н2СО3
Н+ + НСО3-
II. НСО3- Н+ + СО32-
Н2СО3 2Н+ + СО32-
Энергия, которую нужно затратить для отрыва иона, минимальна при его отрыве от нейтральной молекулы и становится больше при диссоциации по каждой следующей ступени
Слайд 29
ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА
Если
Степень диссоциации возрастает при разбавлении раствора
Закон
Оствальда
Слайд 30
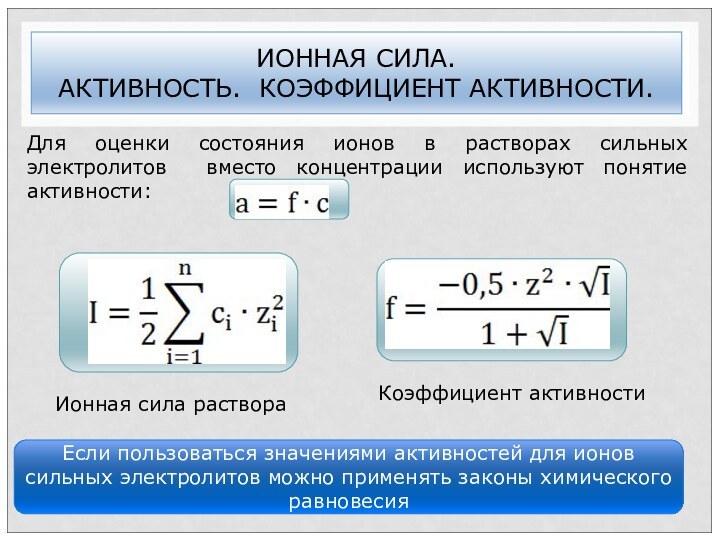
ИОННАЯ СИЛА.
АКТИВНОСТЬ. КОЭФФИЦИЕНТ АКТИВНОСТИ.
Для оценки состояния ионов в
растворах сильных электролитов вместо концентрации используют понятие активности:
Если пользоваться
значениями активностей для ионов сильных электролитов можно применять законы химического равновесия
Ионная сила раствора
Коэффициент активности
Слайд 31
Н2O H+ +OH-
ВОДА. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ.
Вода
– очень слабый амфотерный электролит. Процесс диссоциации выражается уравнением:
Константа,
равная произведению концентраций ионов водорода и гидроксид-ионов, представляет собой постоянную величину при 250С и называется ионным произведением воды.
Слайд 32
КИСЛАЯ СРЕДА
НЕЙТРАЛЬНАЯ СРЕДА
ЩЕЛОЧНАЯ СРЕДА
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ.
Слайд 33
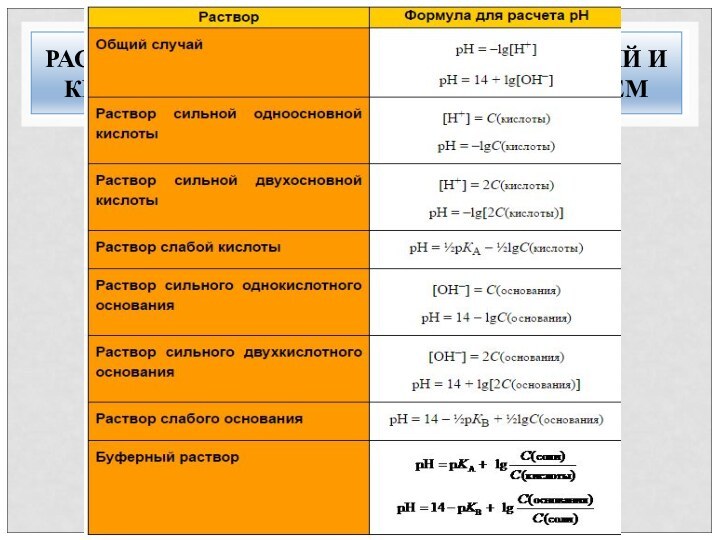
РАСЧЕТ РН РАСТВОРОВ КИСЛОТ, ОСНОВАНИЙ И
КИСЛОТНО-ОСНОВНЫХ БУФЕРНЫХ СИСТЕМ
Слайд 34
СТЕПЕНЬ ГИДРОЛИЗА
Степень гидролиза – число, показывающее, какая часть
от общего числа молей растворенной соли подвергались гидролизу
Чем слабее кислота и основание, входящие в ее состав, тем полнее сдвинуто равновесие гидролиза вправо и, следовательно, больше степень гидролиза.
Слайд 35
КОНСТАНТА ГИДРОЛИЗА
Константа гидролиза определяет состояние химического равновесия в
растворе гидролизованной соли.
Если представить процесс гидролиза уравнением:
Соль + Вода = Кислота + Основание,
То выражение константы гидролиза имеет вид:
Слайд 36
При повышении температуры степень гидролиза возрастает, так как
усиливается диссоциация воды и увеличивается концентрация ионов Н+
и ОН-.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ГИДРОЛИЗ
ТЕМПЕРАТУРА
КОНЦЕНТРАЦИЯ
СОСТАВ РАСТВОРА
2. При уменьшении концентрации соли (разбавлении раствора соли) степень гидролиза увеличивается.
Слайд 37
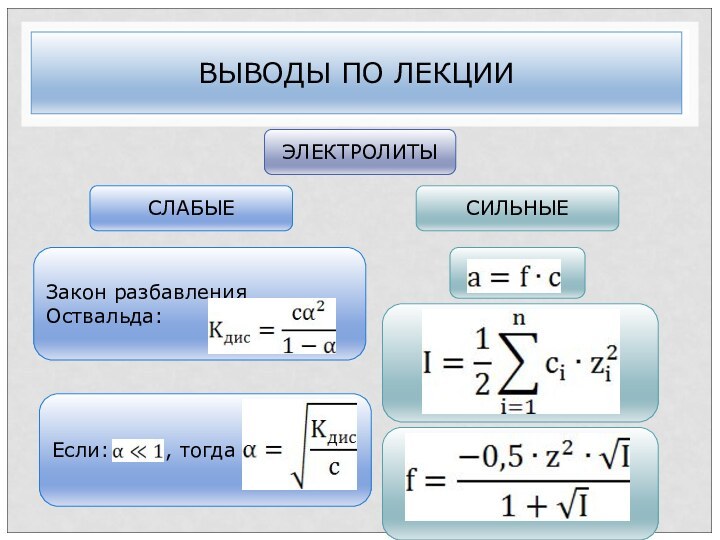
Закон разбавления Оствальда:
ВЫВОДЫ ПО ЛЕКЦИИ
ЭЛЕКТРОЛИТЫ
СЛАБЫЕ
СИЛЬНЫЕ
Если:
, тогда
Слайд 39
СУЩНОСТЬ ХРОМАТОГРАФИИ
Хроматография – это физико-химический метод разделения веществ,
основанный на распределении компонентов смеси между двумя фазами –
подвижной и неподвижной. Молекулы веществ в силу различий их свойств по-разному распределяются между этими фазами.
Слайд 40
СУЩНОСТЬ ХРОМАТОГРАФИИ
Неподвижной фазой обычно служит твердое вещество (его
часто называют сорбентом или адсорбентом) или пленка жидкости, нанесенная
на твердое вещество.
Подвижная фаза представляет собой жидкость или газ, протекающий через неподвижную фазу.
При контакте с поверхностью неподвижной фазы (НФ) компоненты смеси распределяются между подвижной (ПФ) и неподвижной фазами в соответствии с их свойствами (адсорбируемостью, растворимостью или др.).