- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Составление окислительно-восстановительных реакций в заданиях ЕГЭ по химии
Содержание
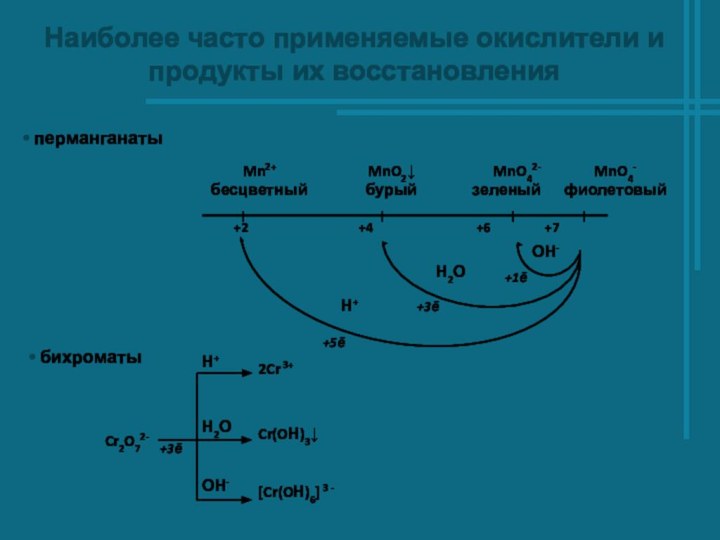
- 2. Наиболее часто применяемые окислители и продукты их восстановления перманганаты бихроматы
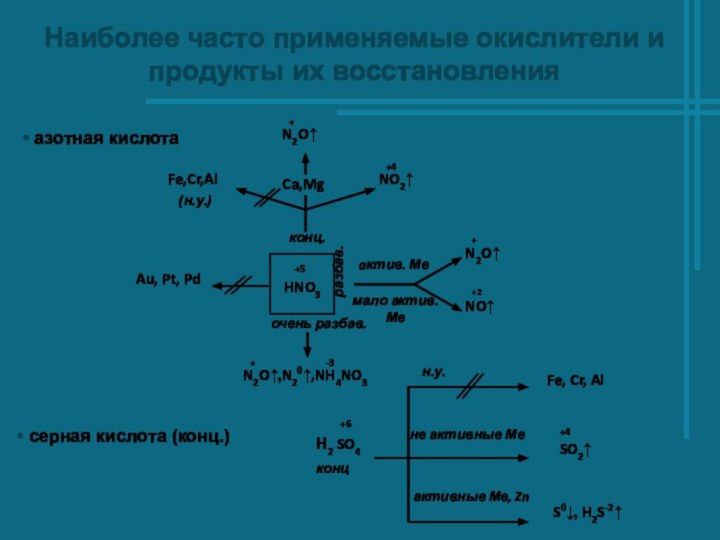
- 3. Наиболее часто применяемые окислители и продукты их восстановления азотная кислота серная кислота (конц.)
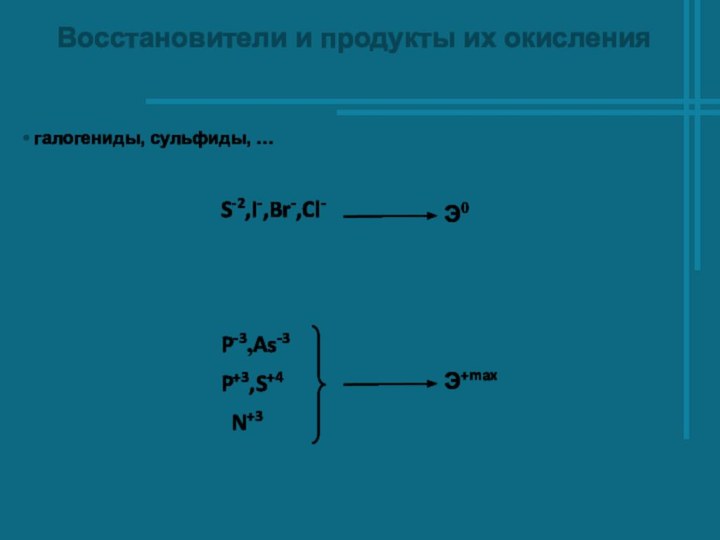
- 4. Восстановители и продукты их окисления галогениды, сульфиды, …
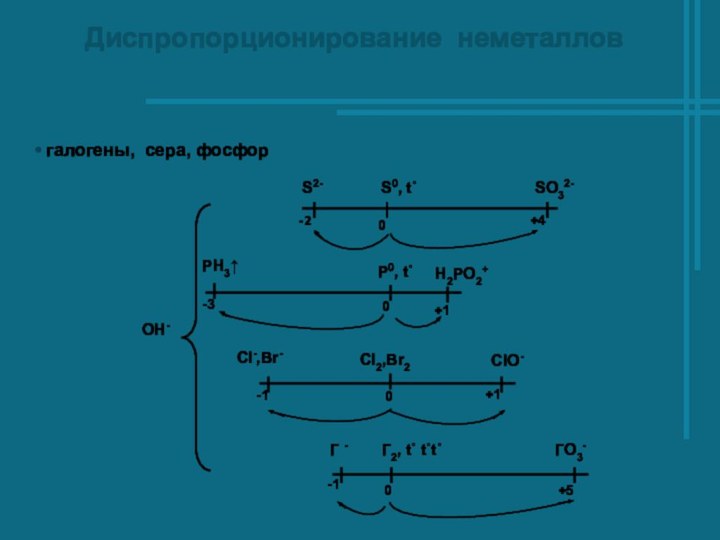
- 5. Диспропорционирование неметаллов галогены, сера, фосфор
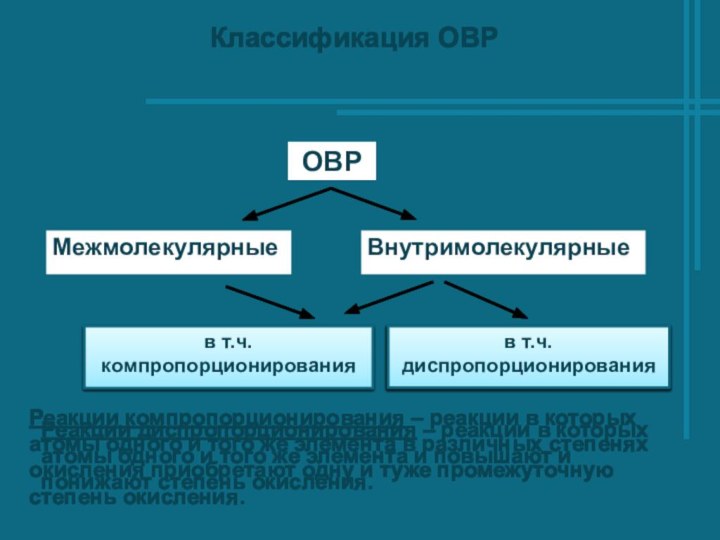
- 6. Классификация ОВРРеакции компропорционирования – реакции в которых
- 7. Виды ОВР в заданиях С1
- 8. Ключевые вещества не пропущеныПример 1:KMnO4 + H2S
- 9. Пропущено ключевое вещество слеваПример 2:KСlO3 + …
- 10. Пропущено ключевое вещество справаПример 3:PH3 + HMnO4
- 11. Советы для предотвращения возможных ошибок1. Учитывайте число
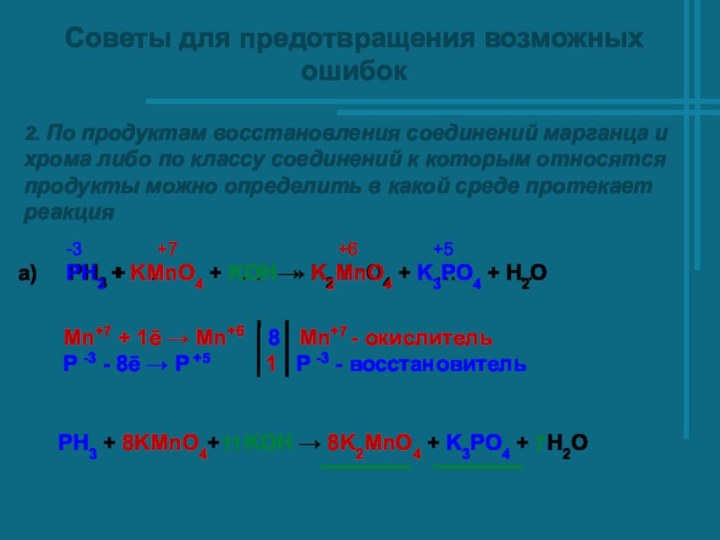
- 12. Советы для предотвращения возможных ошибок2. По продуктам
- 13. Советы для предотвращения возможных ошибок2. По продуктам
- 14. Советы для предотвращения возможных ошибок3. Вода может
- 15. Советы для предотвращения возможных ошибок4. Пероксид водорода
- 16. Советы для предотвращения возможных ошибок4. Пероксид водорода
- 17. Советы для предотвращения возможных ошибок5. В двойных
- 18. Окисление органических веществСH3−CH2−CH= CH2 + KMnO4 + H2SO4 → …8
- 19. Окисление органических веществ
- 20. Скачать презентацию
- 21. Похожие презентации










Слайд 3 Наиболее часто применяемые окислители и продукты их восстановления
азотная кислота
серная кислота (конц.)
Слайд 6
Классификация ОВР
Реакции компропорционирования – реакции в которых атомы
одного и того же элемента в различных степенях окисления
приобретают одну и туже промежуточную степень окисления.Реакции диспропорционирования – реакции в которых атомы одного и того же элемента и повышают и понижают степень окисления.
Слайд 8
Ключевые вещества не пропущены
Пример 1:
KMnO4 + H2S +
H2SO4 → MnSO4 + S + … + …
+7 -2 +2 0 KMnO4 + H2S + H2SO4 → MnSO4 + S + … + …
2KMnO4 + 5H2S + 3H2SO4 → 2MnSO4 + 5S +
K2SO4 + 8H2O
Слайд 9
Пропущено ключевое вещество слева
Пример 2:
KСlO3 + … →
Br2 + KCl + …
+5
0 - 1 KСlO3 + … → Br2 + KCl + …
KСlO3 + → 3Br2 + KCl +
6НBr 3H2O
Слайд 10
Пропущено ключевое вещество справа
Пример 3:
PH3 + HMnO4 →
MnO2 + … + …
-3
+7 +4 PH3 + HMnO4 → MnO2 + … + …
3PH3 + 8HMnO4 → 8MnO2 +
3H3 PO4+ 4H2O
Слайд 11
Советы для предотвращения возможных ошибок
1. Учитывайте число атомов
содержащихся в формульной единице вещества окислителя или восстановителя
FeSO4
+ K2Cr2O7 + H2SO4 → +2 +6 +3 +3
FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
6FeSO4 + K2Cr2O7 + H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
7 7
Слайд 12
Советы для предотвращения возможных ошибок
2. По продуктам восстановления
соединений марганца и хрома либо по классу соединений к
которым относятся продукты можно определить в какой среде протекает реакция
а) PH3 + … + … → K2MnO4 + … + …
-3 +7 +6 +5
PH3 + KMnO4 + KOН → K2MnO4 + K3РO4 + Н2О
PH3 + 8KMnO4+ KOН → 8K2MnO4 + K3РO4 + Н2О
11 7
Слайд 13
Советы для предотвращения возможных ошибок
2. По продуктам восстановления
соединений марганца и хрома либо по классу соединений к
которым относятся продукты можно определить в какой среде протекает реакция
б) PH3 + … + … → MnSO4 + К2SO4 + … + …
-3 +7 +2 +5
PH3 + KMnO4 + H2SO4 → MnSO4 + К2SO4 + H3РO4 + Н2О
5PH3 + 8KMnO4+ H2SO4 → 8MnSO4 + 4К2SO4 + 5H3РO4 + Н2О
12 12
Слайд 14
Советы для предотвращения возможных ошибок
3. Вода может участвовать
в реакции или образовываться
As2O3 + HNO3 + … →
NO2 + …+3 +5 +4 +5
As2O3 + HNO3 + → NO2 + H3AsO4
As2O3 + 4HNO3 + → 4NO2 + 2H3AsO4
H2O
Слайд 15
Советы для предотвращения возможных ошибок
4. Пероксид водорода Н2О2
– вещество с двойственной природой
а) Н2О2 +
КI + H2SO4 → … -1 -1 0 -2
Н2О2 + КI + H2SO4 → I2 + К2SO4 + Н2О
Н2О2 + 2КI + H2SO4 → I2 + К2SO4 + 2Н2О
Слайд 16
Советы для предотвращения возможных ошибок
4. Пероксид водорода Н2О2
– вещество с двойственной природой
б) Н2О2 +
K2Cr2O7 + H2SO4 → … -1 +6 0 +3
Н2О2 + K2Cr2O7 + H2SO4 → О2 + Cr2(SO4)3 + K2SO4 + H2O
3Н2О2 + K2Cr2O7 + 4H2SO4 → 3О2 + Cr2(SO4)3 + K2SO4 + 7H2O
Слайд 17
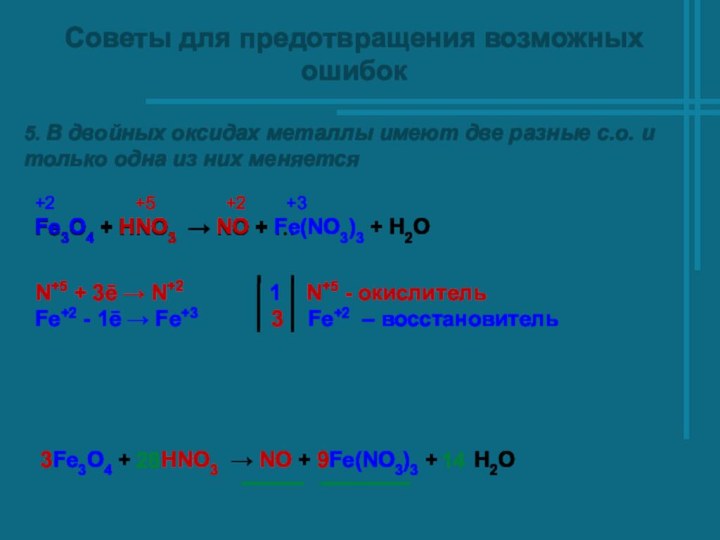
Советы для предотвращения возможных ошибок
5. В двойных оксидах
металлы имеют две разные с.о. и только одна из
них меняется
Fe3O4 + HNO3 → NO + …
+2 +5 +2 +3
Fe3O4 + HNO3 → NO + Fe(NO3)3 + H2O
3Fe3O4 + HNO3 → NO + 9Fe(NO3)3 + H2O
28 14
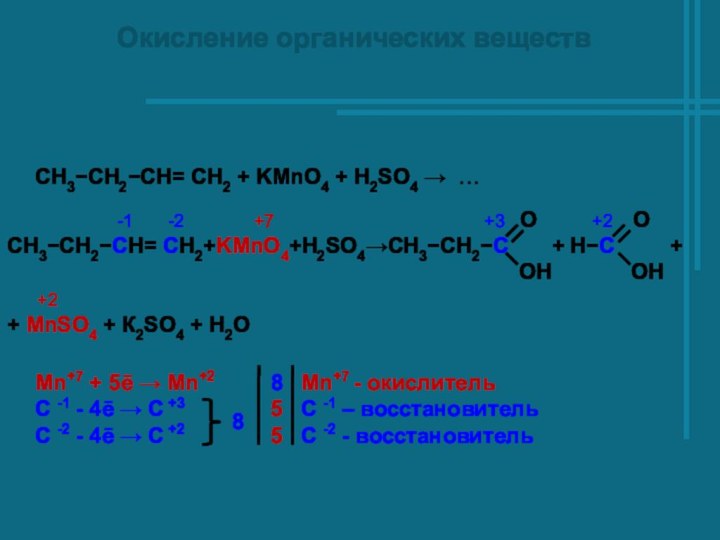
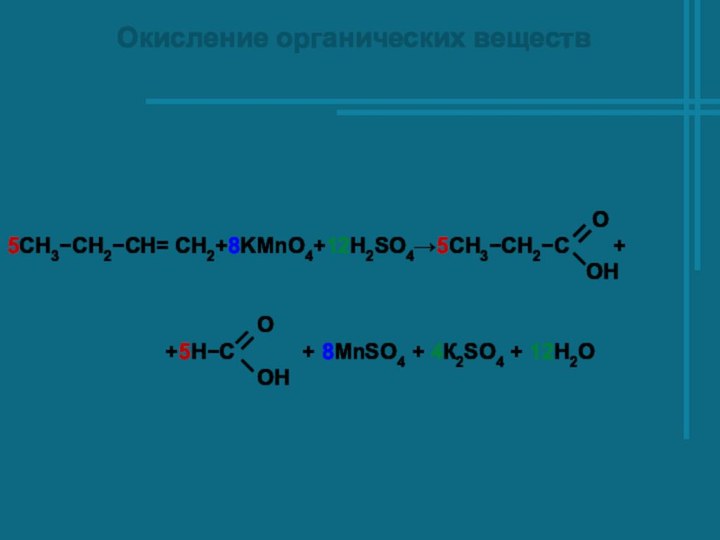
Слайд 19
Окисление органических веществ
O
5СH3−CH2−CH= CH2+8KMnO4+12H2SO4→5СH3−CH2−C +
OH
O
+5H−C + 8MnSO4 + 4К2SO4 + 12Н2О
OH