- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Аммиак соли аммония
Содержание
- 2. Аммиак.
- 3. Строение молекулы аммиака.3. Электронная формула4. Масштабная модель1.
- 4. Вид связи. Форма молекулы.Атом азота связан с
- 5. Получение аммиака в промышленности
- 6. Получение аммиакаАммиак можно получить нагреванием смеси соли
- 7. Аммиак NH3Аммиак- бесцветный газ с резким запахом,
- 8. Химические свойства аммиака: 1. Растворяется в
- 9. Химические свойства аммиака: 2. Аммиак
- 10. Образование иона аммония по механизму донорно-акцепторной связидонор
- 11. Химические свойства аммиака: 3. В
- 12. Химические свойства аммиака: 5. Восстанавливает сложные
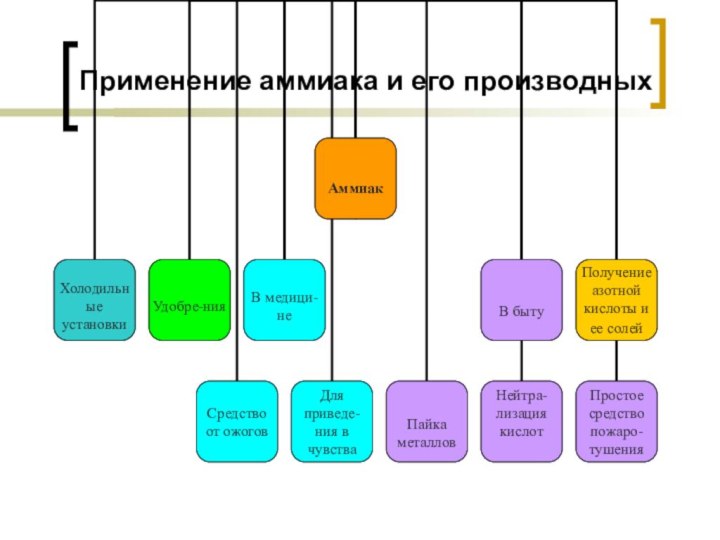
- 13. Применение аммиака и его производных
- 14. Проверь себя: 1.Формула
- 15. Скачать презентацию
- 16. Похожие презентации
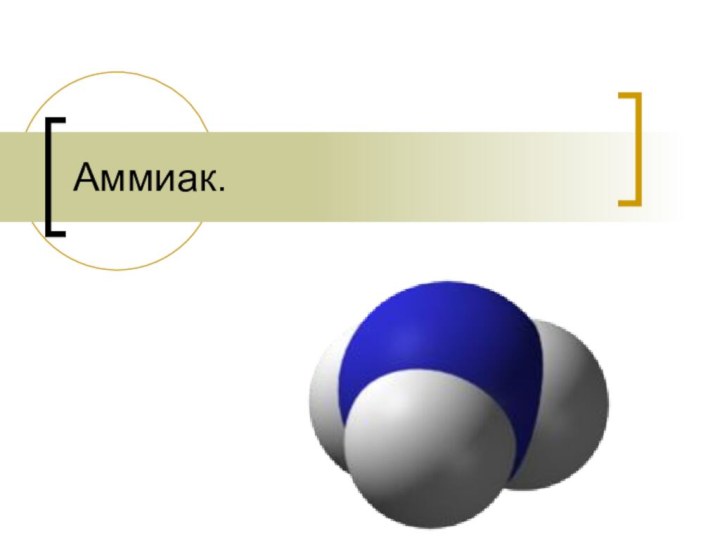
Аммиак.










Слайд 3
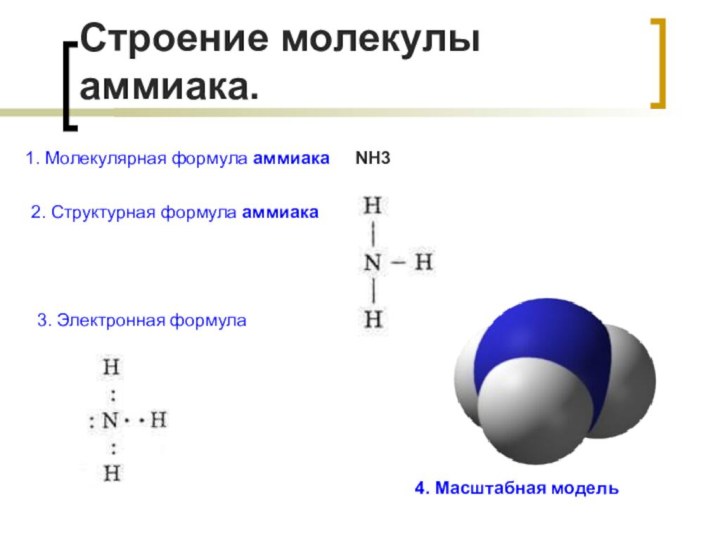
Строение молекулы аммиака.
3. Электронная формула
4. Масштабная модель
1. Молекулярная
формула аммиака NH3
Слайд 4
Вид связи. Форма молекулы.
Атом азота связан с атомами
водорода ковалентной полярной связью. Общие электронные пары частично смещены
к атому азота, поэтому молекула аммиака полярная. При этом у атома азота остаётся неподеленная электронная пара, которая принадлежит только ему. В пространстве молекула аммиака имеет форму пирамиды.
Слайд 6
Получение аммиака
Аммиак можно получить нагреванием смеси соли ‑
хлорида аммония и гидроксида кальция. При нагревании смеси происходит
реакция образования соли, аммиака и воды.2NH4Cl + Ca(OH)2 = 2NH3 ↑ + CaCl2 + 2H2O
Тщательно разотрем ступкой смесь соли и основания и нагреем смесь.
(аммиак - легкий газ).
Слайд 7
Аммиак NH3
Аммиак- бесцветный газ с резким запахом, хорошо
растворим в воде (нашатырный спирт),
tпл.=-780С,
t кип.= - 33,4оС,
легко сжижается, легче воздуха, ядовит. Жидкий аммиак бесцветный, твердый – белого цвета.
Слайд 8
Химические свойства аммиака:
1. Растворяется в воде(при
20 градусах 1 объем воды поглощает до 700 объемов
аммиака):NH3 + H2O → NH4OH (нашатырный спирт)
Слайд 9
Химические свойства аммиака:
2. Аммиак (NH3) взаимодействует
с концентрированными кислотами – соляной HCl, азотной HNO3 и
серной H2SO4.При добавлении кислоты к раствору аммиака появляется белый дым - выделяется соль
NH3 + HCl = NH4Cl↑
хлорид аммония.
NH3 + HNO3 = NH4 NO3↓
нитрат аммония.
2NH3+ H2SO4 = (NH4)2SO4↓
сульфат аммония.
Аммиак взаимодействует со всеми растворимыми в воде
кислотами с образованием солей аммония
Слайд 10
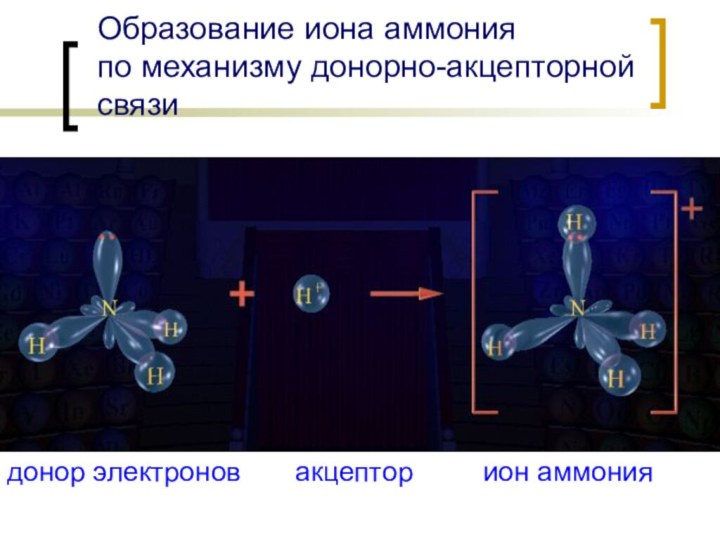
Образование иона аммония
по механизму донорно-акцепторной связи
донор электронов
акцептор ион аммония
Слайд 11
Химические свойства аммиака:
3. В чистом кислороде
сгорает, окисляясь до азота.
Аммиак загорается и горит желтовато- зеленым
пламенемАммиак на воздухе не горит!
4NH3 + 3O2= 2N2 + 6H2O
4. Каталитически окисляется:
4NH3 + 5O2 4NO + 6H2O
Слайд 12
Химические свойства аммиака:
5. Восстанавливает сложные вещества:
3CuO +
2NH3 → 3Cu + N2 + 3H2O
Слайд 14
Проверь себя:
1.Формула аммиака:
а)NH2 б) NH4 в)NH3 г) N2
2.Аммиак: а)легче воздуха, б)тяжелее воздуха, в)не легче и не тяжелее3.Аммиак является: а)окислителем, б)восстановителем, в)и тем, и другим.
4.Ион аммония а)NH2+ б)NH4+ в)NH3– г)NH3
5.Донором электронов при образовании иона
аммония является а) атом азота, б)ион водорода, в)ион аммония
6.Степень окисления азота в аммиаке:
а)0, б)-3, 4)+3, 5)8