2. На примере соединений с ионной и полярной
связью показать механизм электролитической диссоциации ;Учебно-воспитательные цели и задачи урока:
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


















![Урок по теме Электролитическая диссоциацияТема урокаГруппа Дата ТСО Напишите диссоциацию комплексной соли по I ступени[Ag(NH3)2]Cl [Ag(NH3)2]++Cl-Какой знак заряда может](/img/tmb/6/567377/305bb637be7a111f3c737e0043f0779a-720x.jpg)




Учебно-воспитательные цели и задачи урока:
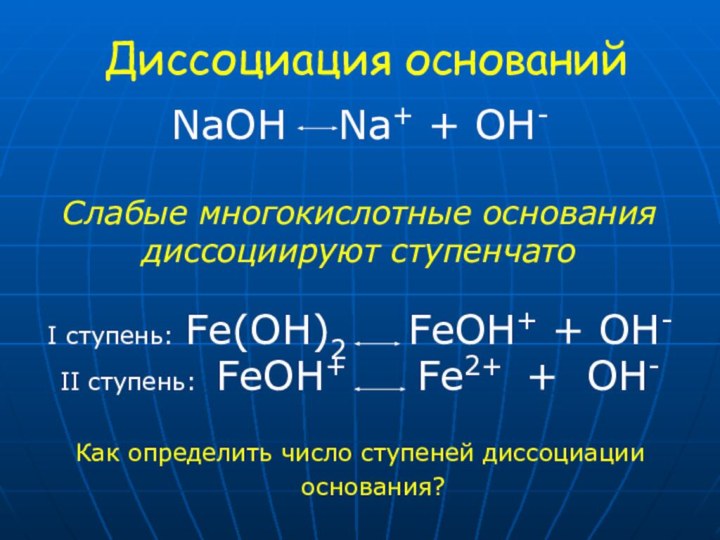
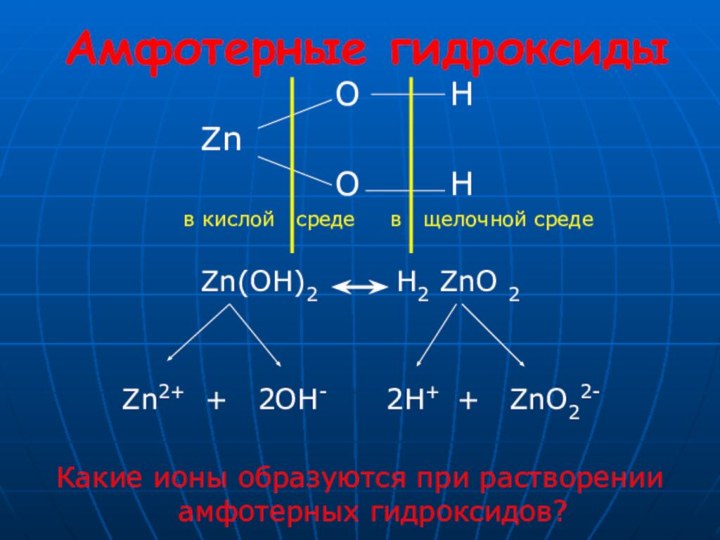
1. Какие вещества называются электролитами?
2. Какой тип связи в предложенных веществах?
3. Почему сухая соль не проводит электрический ток?
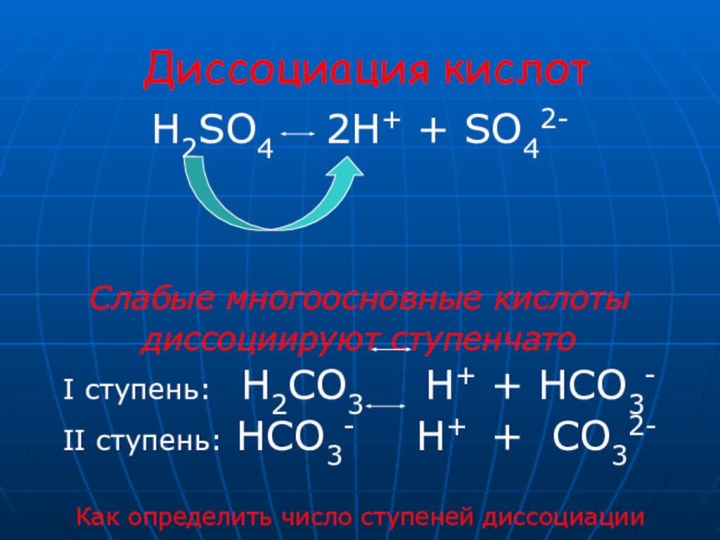
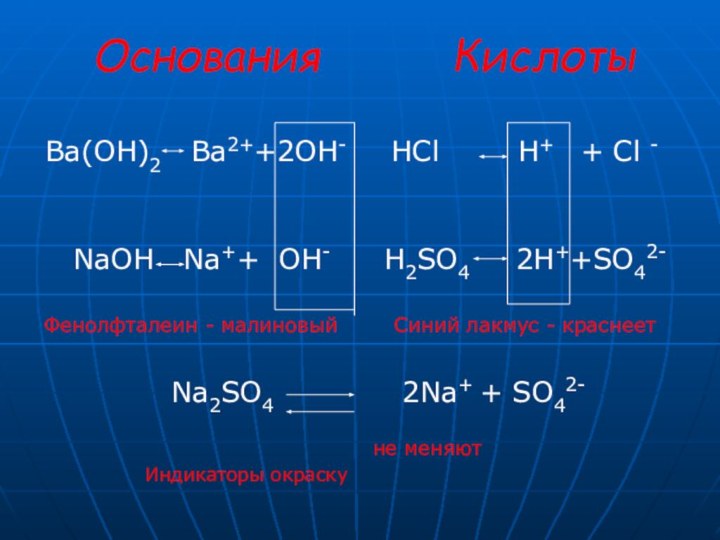
HCl H+ + Cl -
H2SO4 2H++SO42-
Синий лакмус - краснеет
2Na+ + SO42-
не меняют
Вывод: