Слайд 2
Атырауская область
Жылыойский район
г.Кульсары
общеобразовательная средняя школа № 6
УРОК ХИМИИ
ТЕМА: «ЦИНК»
10 класс
Подготовила:
учитель химии
Калпакбаева С.С.
Слайд 3
Тема урока:
«Цинк: химический элемент
и простое вещество»
Цель
урока: углубить и систематизировать знания учащихся о цинке и его соединениях, опытным путём изучить амфотерность оксида и гидроксида цинка, показать практическое значение цинка и его соединениях, способах их распознавания.
Слайд 4
Демонстрация
опыта: лабораторный
опыт 10: распознование ионов меди, железа, цинка. (раствор Zn(OH)2
, соли меди, железа (III) , соли цинка, раствор NaOH и HCE), спиртовка, штатив для пробирок, держатель для пробирок, спички.
Метод обучения: проблемный
Орган. формы: беседа, самостоятельная работа, практическая работа.
Слайд 6
Cтанция 1.
«Визитка химического элемента»:
определите местоположение элемента в
периодической системе, составьте электронную
формулу атома.
Порядковый номер: 30
Период: 4
Группа,
подгруппа: ΙΙ, главная подгруппа, 1s22s22p63s23p63d10 4s2
Слайд 7
Чему равна валентность цинка?
Какая степень окисления характерна для
цинка?
Какими свойствами обладает этот элемент?
Какое простое вещество
образует элемент, который обладает металлическими свойствами?
Значит, цинк – металл.
Слайд 8
Станция 2:
«Физические свойства простого вещества» (работа парами)
Рассмотреть цинковую пластинку и охарактеризовать физические свойства.
Слайд 9
Цинк-металл средней активности.
Плотность = 7,13 г/см3. Чистый
металл пластичен и может быть прокатан в тонкую фольгу.
Технический цинк при обычной t–ре является хрупким, но при 100-1500C он становиться пластичным.
Выше 2000C он опять становится хрупким и его можно растереть в порошок.
t пл.= 419,40C, t кип.= 905,70C.
Его теплопроводность = 60% от теплопроводности серебра, а электропроводимость в 4 раза меньше.
Позволяют ли знания полученные на этой станции, сделать вывод об активности цинка?
Слайд 10
Станция 3:
«Химические свойства простого вещества».
Ι этап –
взаимодействие с простыми веществами
ΙΙ этап – со сложными веществами
Ι этап: составить три реакции цинка с кислородом, серой, хлором. Закончив работу, написать р-ции фломастером на бумаге и поднять его вверх.
+2
– 1
Zn0 +Cl02 → Z n Cl2
4е
2Zn0 +O02 → 2Zn+2O-2
2е
Zn0 + S0 → Zn+2S-2
Чем является цинк в данных реакциях
(восстановителем)
При каких условиях идут эти реакции?
Вывод: цинк – активный металл
Слайд 12
ΙΙ этап:
исследуйте взаимодействие цинка со сложными веществами:
с водой, с соляной кислотой, с гидроксидом натрия. Соблюдать
ТБ
Опыт 1: При нагревании реакция цинка с водой:
2е +1 -2 +2 -2 0
Zn + H2O → ZnO + H2 ↑
Слайд 13
Опыт 2:
В пробирку поместить 2
кусочка
цинка, добавить 1 мл. HCI.
2е + -1 +2 -1 0
Zn0 + 2HCI→ ZnCl2 + H2
Zn0 + 2H + → Zn2+ + H2 ↑
Слайд 14
Взаимодействие цинка с кислотой
Слайд 15
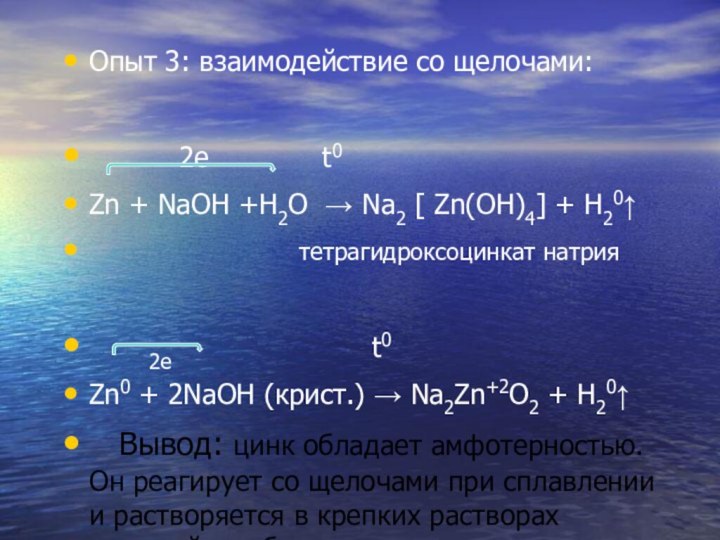
Опыт 3: взаимодействие со щелочами:
2е t0
Zn + NaOH +H2O → Na2 [ Zn(OH)4] + H20↑
тетрагидроксоцинкат натрия
2е t0
Zn0 + 2NaOH (крист.) → Na2Zn+2O2 + H20↑
Вывод: цинк обладает амфотерностью. Он реагирует со щелочами при сплавлении и растворяется в крепких растворах щелочей, особенно при нагревании.
Слайд 16
ΙΙΙ.Первичная проверка усвоения знаний
Станция – «Выбери задание».
В
течении 3 мин неюходимо выполнить одно из трех заданий
своего варианта (по выбору). Выбирайте только те задания , с которым вы справитесь.
Условные обозначения:
Δ – задание на «3»
□ – на «4»
О - на «5»
Слайд 17
Задания:
Δ Закончить уравнение реакции. Напишите его в полном
и сокращенном ионном виде:
Zn + HCI → (вариант
1)
Zn + H2SO4 → (вариант 2)
□ Написать уравнения реакции в соответствии со схемой:
Zn → ZnO → Zn(NO3)2 (вариант 1)
Zn → ZnCI2 → Zn(NO3)2 (вариант 2)
Слайд 18
О Определите неизвестное вещество и напишите ур-я реакции
в соответствии со схемой:
Zn → … → Zn(OH)2 (вариант
1)
Zn → … → ZnCI2 (вариант 2)
Проверка проводится сразу после выполнения работы по готовым ответам на доске.
Слайд 19
ΙV. Первичное закрепление знаний
Если бы мы продолжили
путешествие, на каких станциях вам необходимо было еще побывать?
(«Нахождение в природе», «Получение», «Применение».)
По содержанию в земной коре цинк занимает 23-е место среди других металлов (0,01%)
Сплав цинка с медью - латунь - был известен еще в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. Лишь в 1743 г. в Бристоле заработал первый в Европе цинковый завод. А ведь еще в конце XIII в. Марко Поло Но производство «не пошло», технологические трудности оказались непреодолимыми. Цинк пытались получать точно так же, как и другие металлы. Руду обжигали, превращая цинк в окись, затем эту окись восстанавливали углем...
Но этот материал вы изучите на следующем уроке.
Слайд 20
V. Подведение итогов занятия.
Рефлексия.
Вернемся к теме сегодняшнего урока.
Какую
проблему мы поставили на уроке?
Удалось ли ее решить?
К
какому выводу вы пришли?
Домашнее задание: на основе учебника и опорного конспекта составьте рассказ по данной теме.