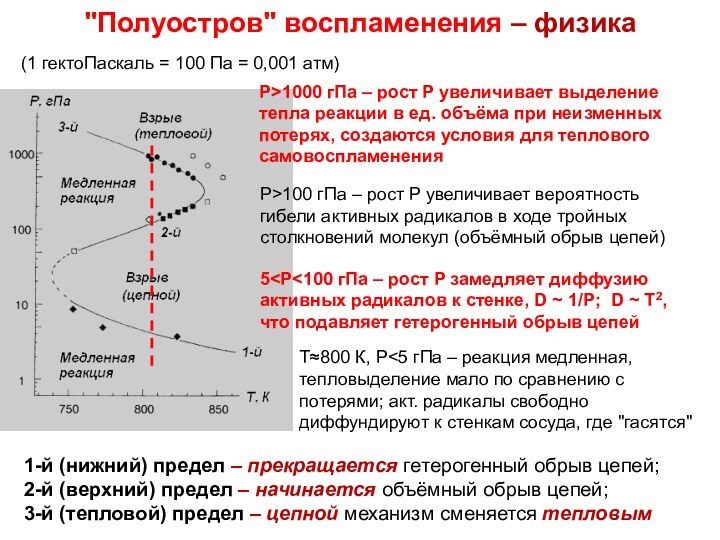
не напрямую между молекулами реагентов, а через промежуточные стадии
– элементарные реакции с промежуточными активными центрами (радикалами) с низкими энергиями активации.В качестве активных центров могут выступать:
атомарные водород Н или кислород О;
радикалы типа ОН и НО2;
перекиси типа Н2О2;
неустойчивые соединения с малой энергией образования/разрушения и т.д.
Лекция 10