- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по Химии для 8 класса Страна кислот
Содержание
- 2. ПЛАН УРОКА:Представители царства кислотТехника безопасности при работе с кислотамиХимические свойства кислотЗакрепление материала темы
- 3. I станция «Информационная»
- 4. ПОДДАННЫЕ КОРОЛЕВСТВА ВСЕ ИМЕЮТ АТОМ АШ.А ОСТАТОК В НИХ КИСЛОТНЫЙДОПОЛНЯЕТ ВЕСЬ ТИПАЖ.
- 5. САМЫЕ ВАЖНЫЕ КИСЛОТЫ
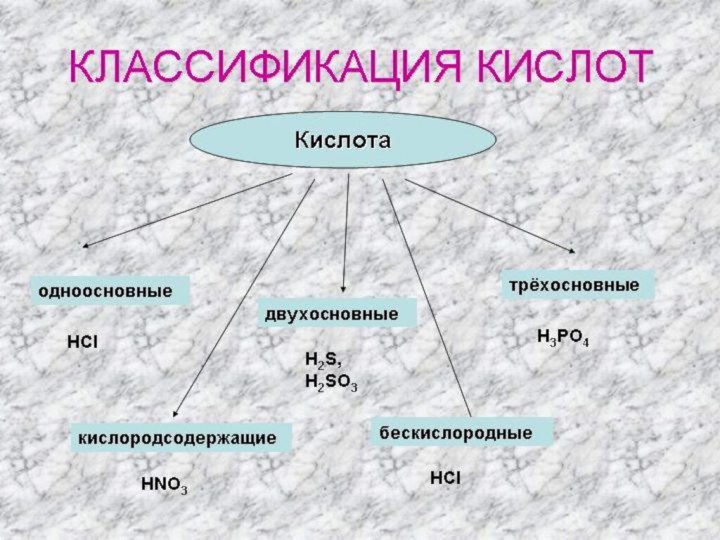
- 7. ЕСТЬ КИСЛОТЫ С КИСЛОРОДОМ,ЕСТЬ КИСЛОТЫ БЕЗ НЕГО.А ОСНОВНОСТЬ ВОДОРОДОМ ОПРЕДЕЛИТЬ ЛЕГЧЕ ВСЕГО.
- 8. Кислоты в природе
- 11. II станция «ПТБ»
- 12. Сначала вода, потом кислота. Иначе случится большая беда!
- 13. Первая помощь при ожогах кислотойСмыть большим количеством водыОбработать 5% раствором питьевой соды
- 14. III станция «Индикаторная» Как распознать кислоты, не
- 15. IV станция «Теоретическая»
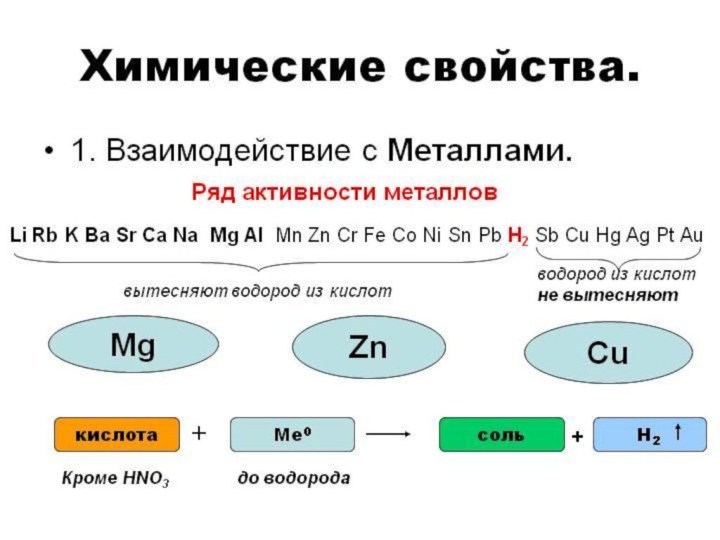
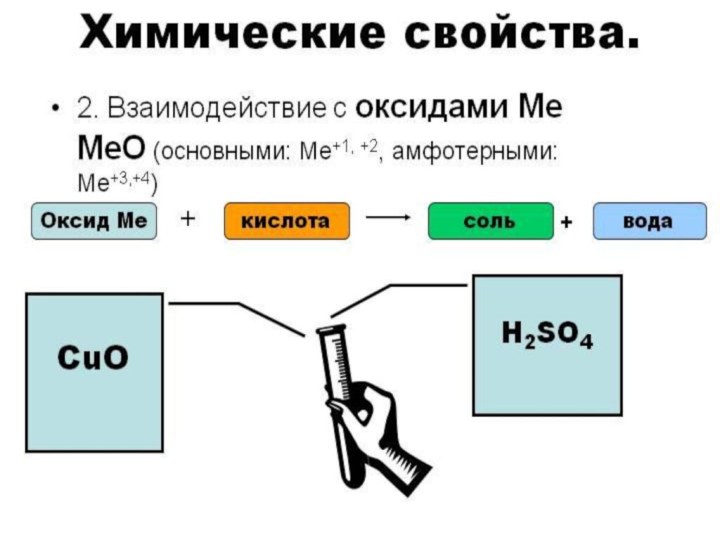
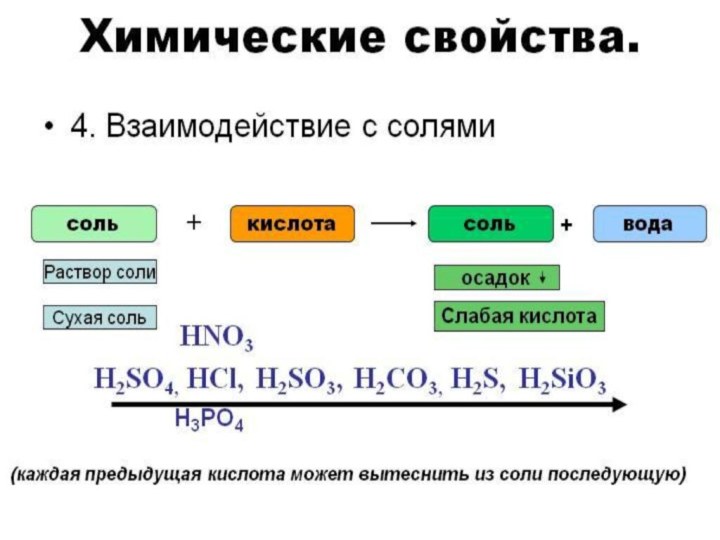
- 16. К СОЛЯМ КИСЛОТЫ АГРЕССИВНЫ,МЕТАЛЛЫ ЛЮБЯТ РАЗРУШАТЬ,НЕ ПОЩАДЯТ ОНИ ОКСИДЫ, И ЩЁЛОЧИ ОТ НИХ «ПИЩАТ».
- 21. Vстанция «Самостоятельная»Проверь себя :Mg + HCl →Zn
- 22. Проверь себя:Mg + 2HCl → Zn +
- 23. Скачать презентацию
- 24. Похожие презентации
ПЛАН УРОКА:Представители царства кислотТехника безопасности при работе с кислотамиХимические свойства кислотЗакрепление материала темы

















Слайд 7
ЕСТЬ КИСЛОТЫ С КИСЛОРОДОМ,
ЕСТЬ КИСЛОТЫ БЕЗ НЕГО.
А ОСНОВНОСТЬ
ВОДОРОДОМ
ОПРЕДЕЛИТЬ ЛЕГЧЕ ВСЕГО.
Слайд 13
Первая помощь при ожогах кислотой
Смыть большим количеством воды
Обработать
5% раствором питьевой соды
Слайд 14 III станция «Индикаторная» Как распознать кислоты, не пробуя их
на вкус?
Для этого существуют вещества, которые называются индикаторами.
Слайд 16
К СОЛЯМ КИСЛОТЫ АГРЕССИВНЫ,
МЕТАЛЛЫ ЛЮБЯТ РАЗРУШАТЬ,
НЕ ПОЩАДЯТ ОНИ
ОКСИДЫ,
И ЩЁЛОЧИ ОТ НИХ «ПИЩАТ».
Слайд 21
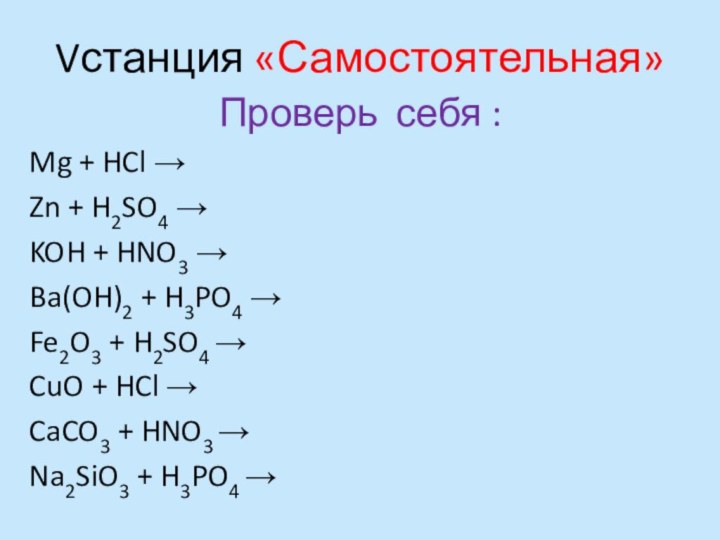
Vстанция «Самостоятельная»
Проверь себя :
Mg + HCl →
Zn +
H2SO4 →
KOH + HNO3 →
Ba(OH)2 + H3PO4 →
Fe2O3
+ H2SO4 →CuO + HCl →
CaCO3 + HNO3 →
Na2SiO3 + H3PO4 →
Слайд 22
Проверь себя:
Mg + 2HCl →
Zn + H2SO4
→
KOH + HNO3 →
3Ba(OH)2 +2H3PO4 →
Fe2O3 +3H2SO4 →
CuO +
2HCl →CaCO3 + 2HNO3 →
3Na2SiO3 + 2H3PO4 →
MgCl2 + H2
ZnSO4 + H2
KNO3 + H2O
Ba3(PO4)2 + 6H2O
Fe2(SO4)3 + 3H2O
CuCl2 + H2O
Ca(NO3)2 + H2O
2Na3PO4 + 3H2SiO3





























