43. Бром
70. Иод
94. Астат
Редкие рассеянные элементы
Галит (каменная
соль) NaClСильвинит NaCl·KCl)
Карналлит KCl·MgCl2·6H2O
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть





![Галогены в природе. Хлор, бром, иод В р-ре KI: KI + I2 (т) = K[I(I)2] I– + I2](/img/tmb/15/1403423/43476fca94fddf0824656ac9260ed70e-720x.jpg)










T-x диаграмма S-Cl (см. рис.):
три соединения: SCl4; SCl2, S2Cl2
T-x диаграмма системы S-Br:
Фаза S2Br2 – конгр. пл. (-40°С) и
инконгр. пл. SBr2;
T-x диаграмма S-I – нет соединений, диаграмма эвтектического типа
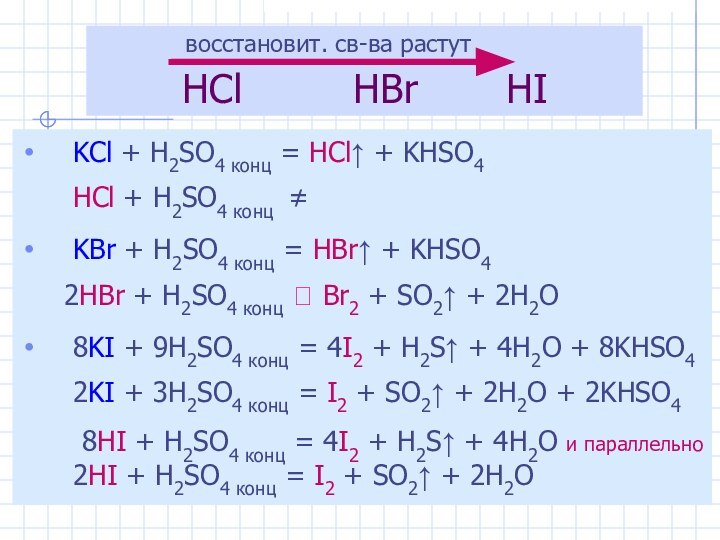
4. 2KBr + Cl2 → 2KCl + Br2
2KI + Br2 → 2KBr + I2
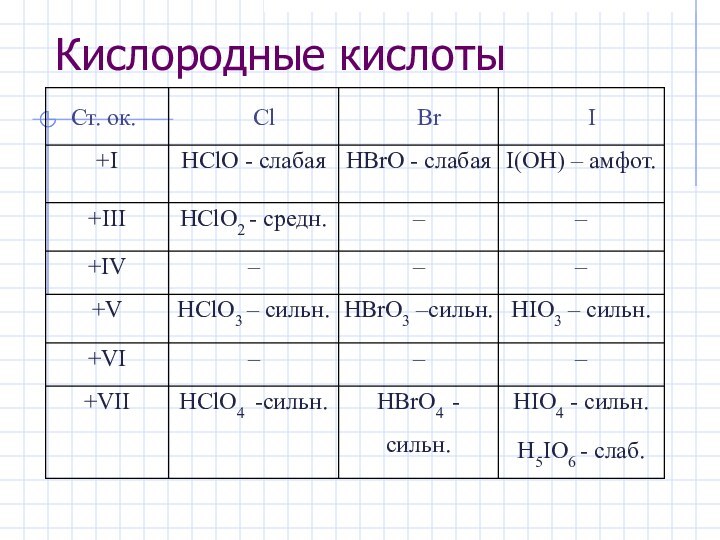
3I2 + 10HNO3 конц. → 6HIO3 + 10NO + 2H2O (HI+5O3)
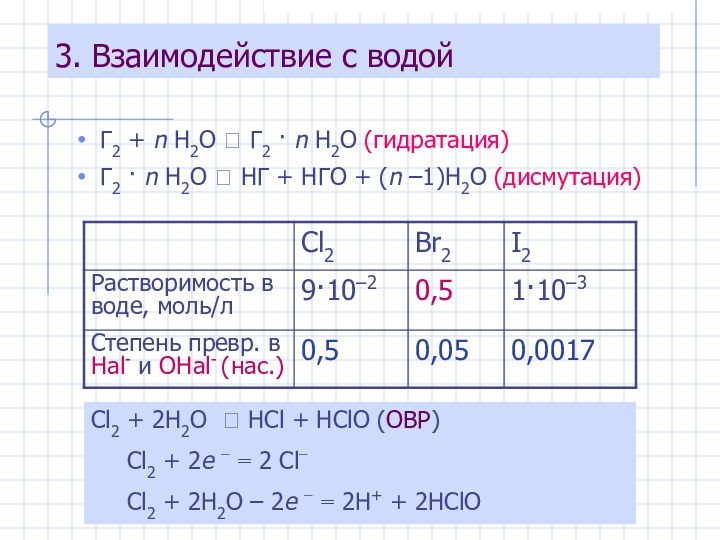
Cl2 + 2H2O ⮀ HCl + HClO (ОВР)
Cl2 + 2e − = 2 Cl−
Cl2 + 2H2O – 2e − = 2H+ + 2HClO
Растворимость галогенов повышается:
Растворение
HCl в воде