Слайд 2
Изучая химию, мы познаем мир.
Слайд 3
Распределите органические вещества на 2 группы:
СН3 –
СН3, СН3 – СН2 –ОН, СН3 – СН2 –
СН3,
СН3 – СН2 – СН2 – СН3,
СН3 – О - СН3, СН3 – СН2 – СОН, СН4 ,
СН3 – СН2 – СН3 ,
СН3 – СН2 – СН2 – СН2 – СН2 – СН3
Слайд 4
Распределите органические вещества на 2 группы:
СН3 –
СН3, СН3 – СН2 –ОН, СН3 – СН2 –
СН3,
СН3 – СН2 – СН2 – СН3,
СН3 – О - СН3, СН3 – СН2 – СОН, СН4 ,
СН3 – СН2 – СН3 ,
СН3 – СН2 – СН2 – СН2 – СН2 – СН3
Слайд 5
Что общего у данных соединений?
СН3 – СН3,
СН3 – СН2 – СН3,
СН3 – СН2 –
СН2 – СН3,
СН4 ,
СН3 – СН2 – СН3
СН3 – СН2 – СН2 – СН2 – СН2 – СН3
СОСТОЯТ ИЗ УГЛЕРОДА И ВОДОРОДА
Слайд 6
Назовите общим понятием данные вещества.
УГЛЕВОДОРОДЫ
Слайд 7
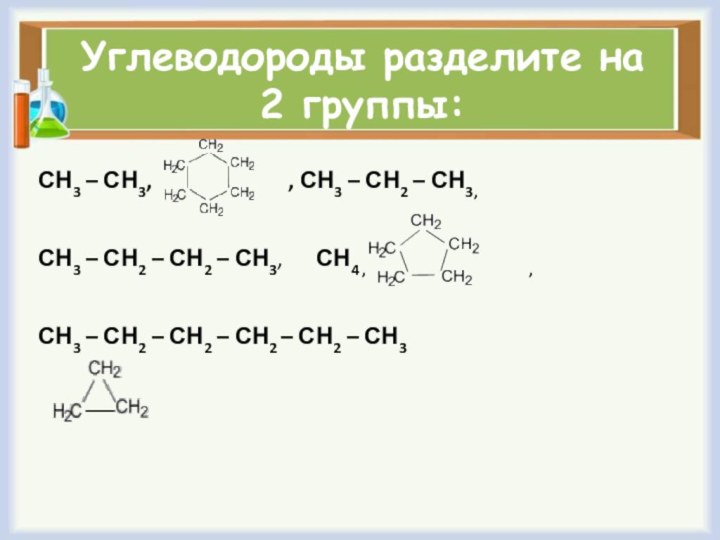
Углеводороды разделите на 2 группы:
СН3 – СН3,
, СН3 – СН2 – СН3,
СН3 – СН2 – СН2 – СН3, СН4 , ,
СН3 – СН2 – СН2 – СН2 – СН2 – СН3
Слайд 8
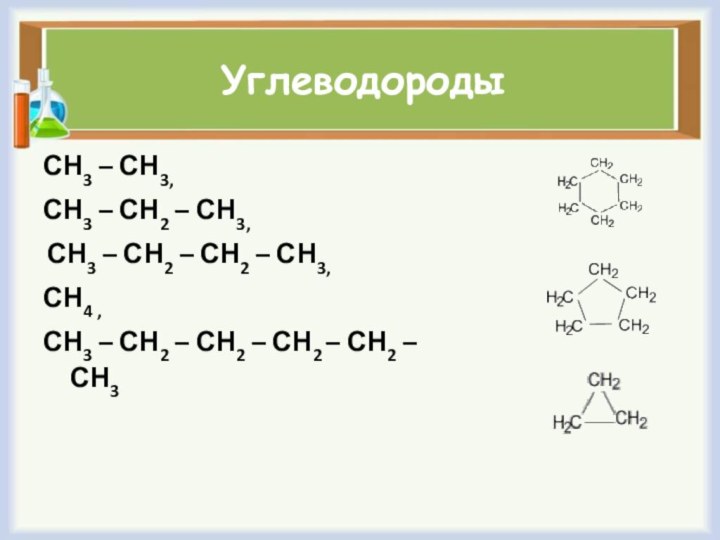
Углеводороды
СН3 – СН3,
СН3 – СН2 – СН3,
СН3
– СН2 – СН2 – СН3,
СН4 ,
СН3 – СН2
– СН2 – СН2 – СН2 – СН3
Слайд 9
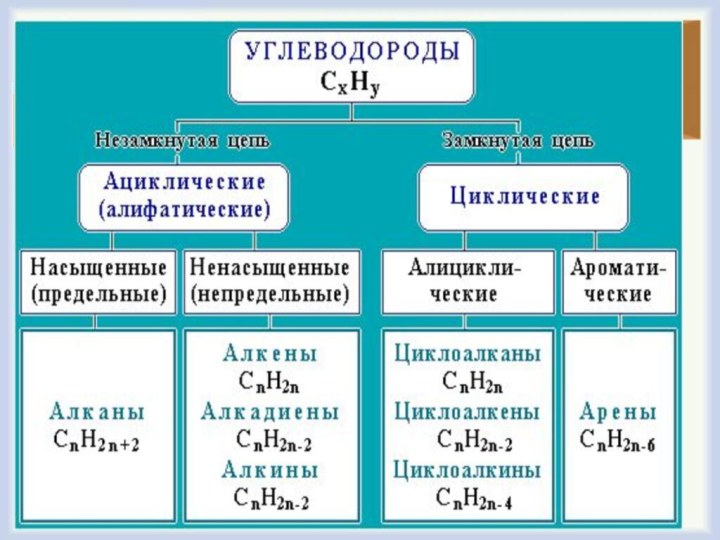
Вывод:
В зависимости от строения углеродной цепи углеводороды подразделяют на две
группы:
ациклические или алифатические;
циклические.
Слайд 11
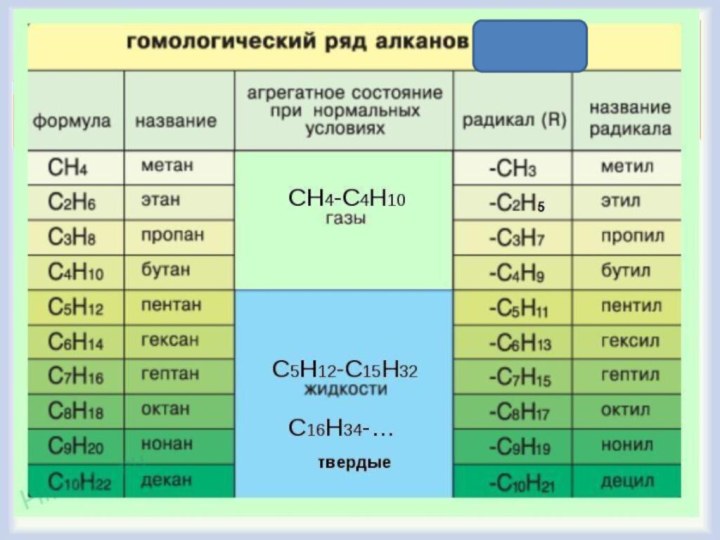
Предельные углеводороды
Алканы, парафины, насыщенные
Слайд 12
Гомологи — вещества, сходные по строению и свойствам и
отличающиеся на одну или более групп СН2.
Слайд 14
Физические свойства алканов
С- С4 — газы.
СН4 —
газ без цвета, вкуса и запаха.
С5 до С15 — жидкости;
более
тяжелые углеводороды — твердые вещества.
Плохо растворяются в воде.
Слайд 16
Химические свойства метана:
Горение
Запишите уравнение реакции.
CH4 + 2O2 → CO2 +2H2O
+ Q
Какой химический процесс изображен?
Слайд 17
Предположите какие еще характерны реакции для алканов.
Подсказка: ПРЕДЕЛЬНЫЕ!!!!
Слайд 18
Химические свойства метана:
Реакции замещения
СН4+Cl2 → CH3Cl+HCl
хлорметан
СН3Cl+Cl2 → CH2Cl2+HCl
дихлорметан
СН2Cl2+Cl2 → CHCl3+HCl
трихлорметан
СН3Cl+Cl2 → CCl4+HCl
тетрахлорметан
Разложение
СН4→ С+2Н2
(получение сажи и водорода)
2СН4→С2Н2+3Н2
(получение ацетилена)
Слайд 19
Найдите в тексте где используются продукты реакций замещения
и разложения метана.
Водород, который получают термическим разложением предельных углеводородов,
используется в синтезе аммиака. Все приведенные хлорпроизводные метана находят широкое применение. Хлористый метил (хлорметан) является хорошим растворителем. Дихлорметан, трихлорметан используются в медицине. Четыреххлористый углерод, тяжелая жидкость (tкип = +76,5 °С), используется в качестве растворителя, а также при тушении пожаров.
Слайд 20
Закрепление:
Составьте молекулярные формулы алканов, в молекулах которых содержится:
а) 7 атомов углерода; б) 9 атомов углерода; в)
22 атома водорода. Образуйте от них радикалы.
Напишите уравнение реакции горения пропана. Расставьте коэффициенты и докажите, что эта реакция окислительно-восстановительная.
Слайд 21
Домашнее задание:
1. Найти области применения этана.
2. Какие
химические свойства можно предположить у этана? Запишите уравнения химических
реакций.
3. Выучить 5 первых алканов.
Слайд 22
интернет-конкурс «Лучшее оформление образовательной презентации»
http://pedsovet.su/
Слайд 23
источник шаблона
Кудрявцева Ирина Александровна
МОУ «Средняя общеобразовательная школа №
53» г. Омска
Учитель химии