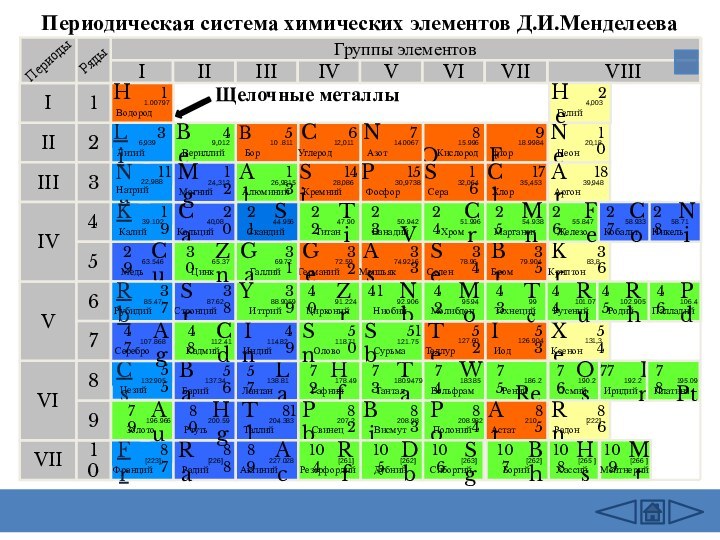
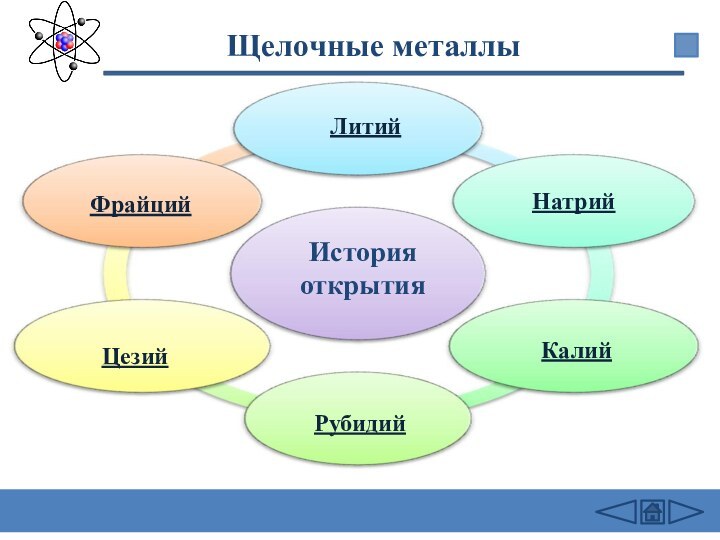
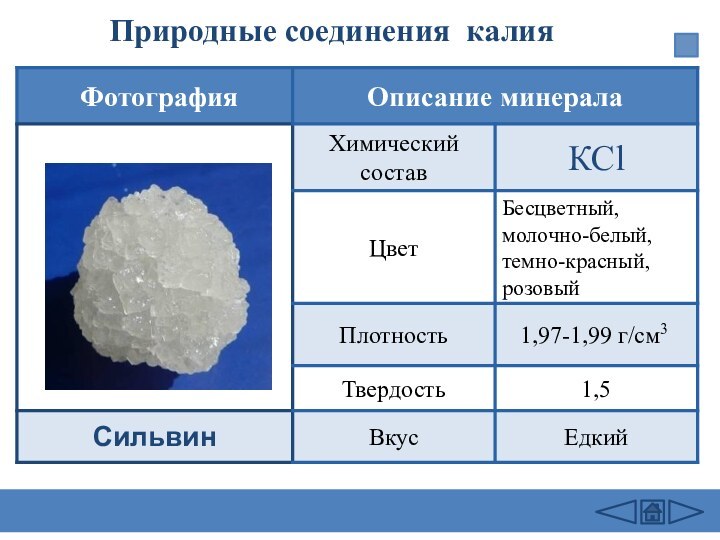
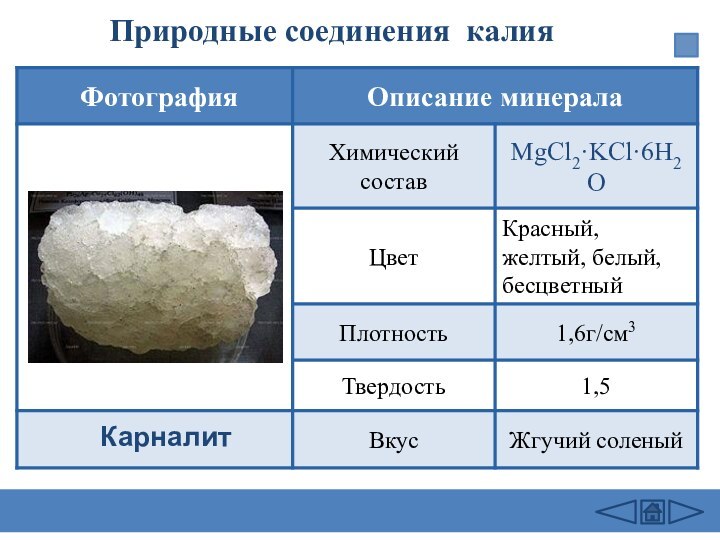
заведений.-М.: Дрофа,
Ахметов Н. С. Общая и неорганическая химия.
— М.: Высшая школа, 2001
Лидин Р. А., Андреева Л. Л., Молочко В. А. Справочник по неорганической химии. — М.: Химия, 1987.
Некрасов Б. В. Основы общей химии. — М.: Химия, 1974.
Неорганическая химия. Весь школьный курс в таблицах,сост. МанкувичН.В., М. 2008г
“Видеоопыты из диска "Splint. Химия для всех - XXI: Самоучитель решению химических задач"
http://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82
http://www.catalogmineralov.ru/
http://www.xumuk.ru/encyklopedia/2/5263.html
http://www.physchem.chimfak.rsu.ru/Source/History/Persones/
Литература и интернет-ресурсы