- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему к уроку Классификации химических реакций в неорганической и органической химии
Содержание
- 2. ЧТО ТАКОЕ ХИМИЧЕСКАЯ РЕАКЦИЯ?
- 3. ?
- 4. КЛАССИФИКАЦИЯ По числу и составу реагирующих и
- 5. ОФОРМЛЯЕМ ТАБЛИЦУ:
- 6. I. ПО ЧИСЛУ И СОСТАВУ РЕАГИРУЮЩИХ И
- 7. РЕАКЦИИ, ИДУЩИЕ С ИЗМЕНЕНИЕМ СОСТАВА ВЕЩЕСТВА
- 8. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ1. Классификация органических реакций по
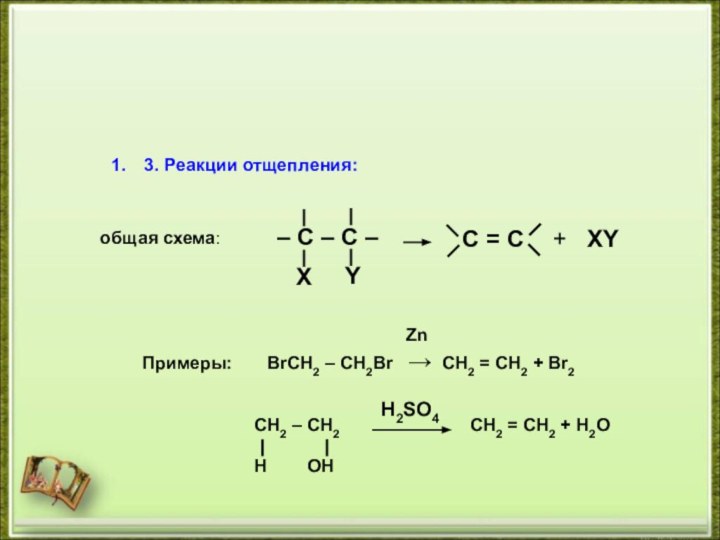
- 9. 3. Реакции отщепления:C = C+ XYобщая схема:
- 10. II. ПО ИЗМЕНЕНИЮ СТЕПЕНЕЙ ОКИСЛЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВОкислительно-восстановительные
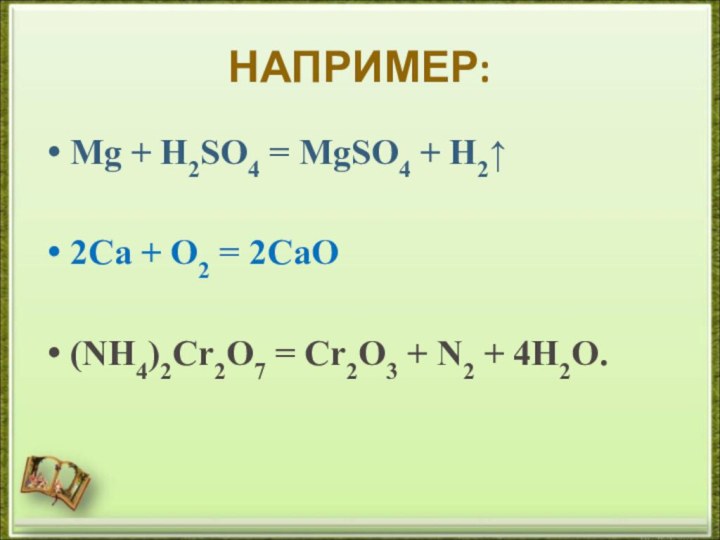
- 11. НАПРИМЕР:Mg + H2SO4 = MgSO4 + H2↑2Ca + O2 = 2CaO(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
- 12. III. ПО ИСПОЛЬЗОВАНИЮ КАТАЛИЗАТОРА: Некаталитические
- 13. IV. ПО НАПРАВЛЕНИЮ: Необратимые реакции протекают
- 14. V. ПО ТЕПЛОВОМУ ЭФФЕКТУ: Эндотермические реакции протекают
- 15. VI. ПО МЕХАНИЗМУ:Ионные реакции – идут между
- 16. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙКлассификация реакций по их механизму: В
- 17. VII. ПО ВИДУ ЭНЕРГИИ, ИНИЦИИРУЮЩЕЙ РЕАКЦИЮ: Фотохимические
- 18. VIII. ПО ФАЗОВОМУ СОСТАВУ: Гетерогенные реакции –
- 19. ОПРЕДЕЛИТЕ ТИП РЕАКЦИИ:
- 20. РЕФЛЕКСИЯ:«Синквейн»1 строка – тема или предмет (одно
- 21. Скачать презентацию
- 22. Похожие презентации



















Слайд 3
?
Вокруг
нас и внутри нас непрерывно осуществляются тысячи разнообразных химических
реакций.Как сориентироваться в многообразии химических реакций?
Слайд 4
КЛАССИФИКАЦИЯ
По числу и составу реагирующих и образующихся
веществ
По изменению степени окисления атомов элементов
По использованию катализатора
По направлению
По тепловому эффектуПо механизму
По виду энергии, инициирующей реакцию
По фазовому составу
Слайд 6 I. ПО ЧИСЛУ И СОСТАВУ РЕАГИРУЮЩИХ И ОБРАЗУЮЩИХСЯ
ВЕЩЕСТВ:
Реакции, идущие без изменения состава веществ.
В неорганической химии к
таким реакциям относят процессы получения аллотропных модификаций одного химического элемента, например:превращение графита в алмаз при давлении 6 ГПа и температуре 1500 °C в присутствии катализатора
Слайд 7
РЕАКЦИИ, ИДУЩИЕ С ИЗМЕНЕНИЕМ СОСТАВА ВЕЩЕСТВА
Определите по схемам
о каких реакциях идет речь?
A + B = AB
AB
= A + BA + BC =AC + B
AB+CD = AD+CB
Определите тип химической реакции:
2Na + 2H2O = 2NaOH + H2⭡
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3⭡ + 2H2O
2SO2 + O2 = 2SO3
2KMnO4=K2MnO4+MnO2+ O2⭡
Слайд 8
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
1. Классификация органических реакций по изменению
числа частиц в ходе реакции
1. 1.Реакции замещения:
общая схема:
R – X + Y → R – Y + X пример: CH4 + Br2 → CH3Br + HBr
1.2. Реакции присоединения:
C = C
+ XY →
общая схема:
примеры: CH2 = CH2 + HCl → CH3 – CH2 – Cl
CH2 = CH2 + Br2 → BrCH2 – CH2Br
Слайд 10
II. ПО ИЗМЕНЕНИЮ СТЕПЕНЕЙ ОКИСЛЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Окислительно-восстановительные реакции
– это реакции, идущие с изменением степеней окисления элементов.
Все реакции замещения, а также реакции соединения и разложения, в которых участвует хотя бы одно простое вещество.
Слайд 12
III. ПО ИСПОЛЬЗОВАНИЮ КАТАЛИЗАТОРА:
Некаталитические реакции – реакции,
идущие без участия катализатора:
t2HgO = 2Hg + O2↑
Каталитические реакции – реакции, идущие с участием катализатора:
MnO2
2H2O2 = 2H2O + O2↑
Слайд 13
IV. ПО НАПРАВЛЕНИЮ:
Необратимые реакции протекают в данных условиях
только в одном направлении:
BaCl2+H2SO4=2HCl+BaSO4↓
РИО
Обратимые реакции в данных условиях протекают
одновременно в двух направлениях:N2O4 ⮀ 2NO2
Слайд 14
V. ПО ТЕПЛОВОМУ ЭФФЕКТУ:
Эндотермические реакции протекают с поглощением
энергии:
N2 + O2 = 2NO – Q кДж
Когда в
природе протекает данная реакция? Экзотермические реакции протекают с выделением энергии:
CH4+ 2O2=CO2+2H2O + Q кДж
Где протекает данная реакция?
Слайд 15
VI. ПО МЕХАНИЗМУ:
Ионные реакции – идут между уже
имеющимися или образующимися в ходе реакции ионами:
C2H4 + HBr =
C2H5BrРадикальные реакции – идут между образующимися в ходе реакции радикалами и молекулами:
CH4+Cl2 =CH3Cl+HCl
Слайд 16
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
Классификация реакций по их механизму:
В этом
случае ориентируются на способ разрыва ковалентной связи. Этих способов
два:Гомологический (радикальный) разрыв ковалентной связи:
А : В → А• + •В
радикалы
Гетероциклический (ионный) разрыв ковалентной связи:
А : В → А+ + (:В)–
ионы
Слайд 17
VII. ПО ВИДУ ЭНЕРГИИ, ИНИЦИИРУЮЩЕЙ РЕАКЦИЮ:
Фотохимические реакции инициируются
световой энергией.
Радиационные реакции инициируются излучениями большой энергии – рентгеновскими
лучами, ядерными излучениями.Электрохимические реакции инициируются электрическим током (электролиз).
Термохимические реакции инициируются тепловой энергией.
Слайд 18
VIII. ПО ФАЗОВОМУ СОСТАВУ:
Гетерогенные реакции – реакции, в
которых реагирующие вещества и продукты находятся в разных агрегатных
состояниях.Гомогенные реакции – реакции, в которых реагирующие вещества и продукты находятся в одном агрегатном состоянии (в одной фазе).
Слайд 19
ОПРЕДЕЛИТЕ ТИП РЕАКЦИИ:
Ni
C2H4+H2 ↔ C2H6 + Q
Классифицируйте эту реакцию по разным признакам.