- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Алкены (10 класс)
Содержание
- 2. СОДЕРЖАНИЕ1.ОПРЕДЕЛЕНИЕ2.НОМЕНКЛАТУРА АЛКЕНОВ3.ИЗОМЕРИЯ АЛКЕНОВ4.СТРОЕНИЕ АЛКЕНОВ5.ПОЛУЧЕНИЕ АЛКЕНОВ6.ФИЗИЧЕСКИЕ СВОЙСТВА7.ХИМИЧЕСКИЕ СВОЙСТВА8.ПРИМЕНЕНИЕ АЛКЕНОВ
- 3. ОПРЕДЕЛЕНИЕ АЛКЕНЫ – НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ, В МОЛЕКУЛАХ
- 4. НОМЕНКЛАТУРА АЛКЕНОВ
- 5. ИЗОМЕРИЯ АЛКЕНОВ
- 6. СТРОЕНИЕ АЛКЕНОВ
- 7. СТРОЕНИЕ АЛКЕНОВ
- 8. ПОЛУЧЕНИЕ АЛКЕНОВ1.КРЕКИНГ НЕФТЕПРОДУКТОВ:СН3 –СН2 –СН2 –СН3 →
- 9. ПОЛУЧЕНИЕ АЛКЕНОВ3.ДЕГИДРАТАЦИЯ СПИРТОВ:4.ДЕГИДРОГАЛОГЕНИРОВАНИЕ:H3C-CH2-CH2BR + NAOH(СПИРТ.Р-Р) → NABR+ H2O + + H3C-CH=CH2
- 10. ПОЛУЧЕНИЕ АЛКЕНОВ5.Дегалогенирование:
- 11. ФИЗИЧЕСКИЕ СВОЙСТВА ЭТЕН,ПРОПЕН, БУТЕН – ГАЗЫС5Н10 – С16Н32 - ЖИДКОСТИ ВЫСШИЕ АЛКЕНЫ – ТВ.ВЕЩЕСТВА
- 12. ХИМИЧЕСКИЕ СВОЙСТВАI.РЕАКЦИИ ПРИСОЕДИНЕНИЯ:1.ГИДРИРОВАНИЕ : CH2=CH-CH3+Н2 → CH3-CH2-CH3
- 13. ХИМИЧЕСКИЕ СВОЙСТВАI.РЕАКЦИИ ПРИСОЕДИНЕНИЯ:4.ГИДРАТАЦИЯ:5.ПОЛИМЕРИЗАЦИЯ:
- 14. ХИМИЧЕСКИЕ СВОЙСТВАII.РЕАКЦИИ ОКИСЛЕНИЯ:1.ПОЛНОЕ ОКИСЛЕНИЕ (ГОРЕНИЕ): С2Н4 +
- 15. ПРИМЕНЕНИЕ АЛКЕНОВ
- 16. Скачать презентацию
- 17. Похожие презентации
СОДЕРЖАНИЕ1.ОПРЕДЕЛЕНИЕ2.НОМЕНКЛАТУРА АЛКЕНОВ3.ИЗОМЕРИЯ АЛКЕНОВ4.СТРОЕНИЕ АЛКЕНОВ5.ПОЛУЧЕНИЕ АЛКЕНОВ6.ФИЗИЧЕСКИЕ СВОЙСТВА7.ХИМИЧЕСКИЕ СВОЙСТВА8.ПРИМЕНЕНИЕ АЛКЕНОВ














Слайд 2
СОДЕРЖАНИЕ
1.ОПРЕДЕЛЕНИЕ
2.НОМЕНКЛАТУРА АЛКЕНОВ
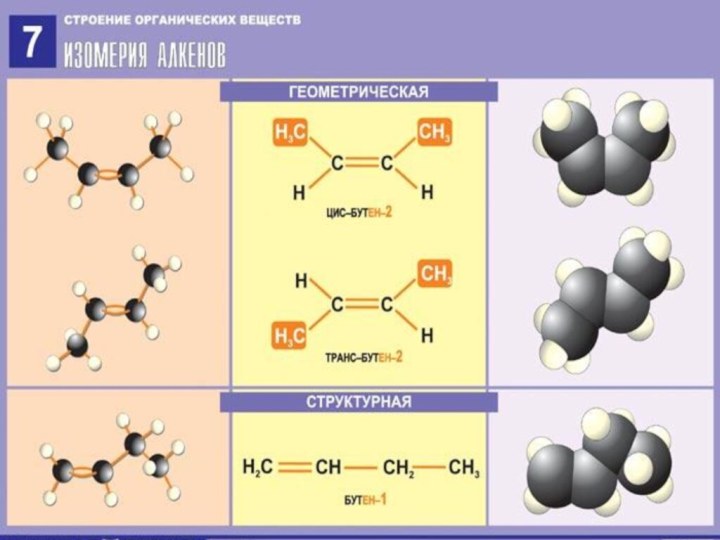
3.ИЗОМЕРИЯ АЛКЕНОВ
4.СТРОЕНИЕ АЛКЕНОВ
5.ПОЛУЧЕНИЕ АЛКЕНОВ
6.ФИЗИЧЕСКИЕ СВОЙСТВА
7.ХИМИЧЕСКИЕ СВОЙСТВА
8.ПРИМЕНЕНИЕ АЛКЕНОВ
Слайд 3
ОПРЕДЕЛЕНИЕ
АЛКЕНЫ – НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ, В МОЛЕКУЛАХ КОТОРЫХ
МЕЖДУ АТОМАМИ УГЛЕРОДА ИМЕЕТСЯ ОДНА ДВОЙНАЯ СВЯЗЬ.
СNH2N , ГДЕ N ≥2
Слайд 4
НОМЕНКЛАТУРА АЛКЕНОВ
СН2
= СН2 ЭТЕН (ЭТИЛЕН)
СН3 – СН = СН2 ПРОПЕН (ПРОПИЛЕН)4 3 2 1 1 2 3 4
СН3 – СН2 – СН = СН2 СН3 – СН = СН – СН3
БУТЕН -1 (БУТИЛЕН-1) БУТЕН -2 (БУТИЛЕН-2)
5 4 3 2 1
СН3 – СН – CH2 – CH=CH2
|
CH3 4 – МЕТИЛПЕНТЕН -1
Слайд 6
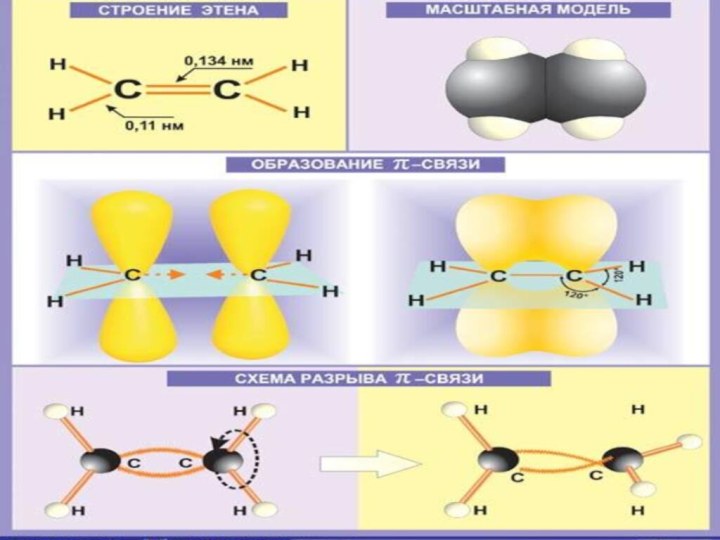
СТРОЕНИЕ АЛКЕНОВ
СН2 = СН2 ЭТИЛЕН (ЭТЕН)
ДВОЙНАЯ СВЯЗЬ: Σ-СВЯЗЬ+Π-СВЯЗЬ ТИП ГИБРИДИЗАЦИИ: SP²
ВАЛЕНТНЫЙ УГОЛ: 120°
ФОРМА МОЛЕКУЛЫ:
ПЛОСКОСТНАЯ (ТРЕУГОЛЬНАЯ)
Слайд 8
ПОЛУЧЕНИЕ АЛКЕНОВ
1.КРЕКИНГ НЕФТЕПРОДУКТОВ:
СН3 –СН2 –СН2 –СН3 → СН2
= СН2 + СН3 – СН3
2.ДЕГИДРИРОВАНИЕ АЛКАНОВ:
PTСН3 – СН3 → СН2 = СН2 + Н2
Слайд 9
ПОЛУЧЕНИЕ АЛКЕНОВ
3.ДЕГИДРАТАЦИЯ СПИРТОВ:
4.ДЕГИДРОГАЛОГЕНИРОВАНИЕ:
H3C-CH2-CH2BR + NAOH(СПИРТ.Р-Р) → NABR+ H2O
+ + H3C-CH=CH2
Слайд 11
ФИЗИЧЕСКИЕ СВОЙСТВА
ЭТЕН,ПРОПЕН, БУТЕН – ГАЗЫ
С5Н10 – С16Н32
- ЖИДКОСТИ
ВЫСШИЕ АЛКЕНЫ – ТВ.ВЕЩЕСТВА
Слайд 12
ХИМИЧЕСКИЕ СВОЙСТВА
I.РЕАКЦИИ ПРИСОЕДИНЕНИЯ:
1.ГИДРИРОВАНИЕ :
CH2=CH-CH3+Н2 → CH3-CH2-CH3
2.ГАЛОГЕНИРОВАНИЕ:
CH2=CH-CH3+CL2 → CH2CL-CHCL-CH3
3.ГИДРОГАЛОГЕНИРОВАНИЕ:
CH2=CH-CH3+НCL → CH3-CHCL-CH3
Слайд 14
ХИМИЧЕСКИЕ СВОЙСТВА
II.РЕАКЦИИ ОКИСЛЕНИЯ:
1.ПОЛНОЕ ОКИСЛЕНИЕ (ГОРЕНИЕ):
С2Н4 + 3О2
→ 2СО2 + 2Н2О
2.НЕПОЛНОЕ ОКИСЛЕНИЕ:
3С2Н4 + 2KMNO4 +4Н2О →3HOCH2-CH2OH
++2MNO2 + 2KOH