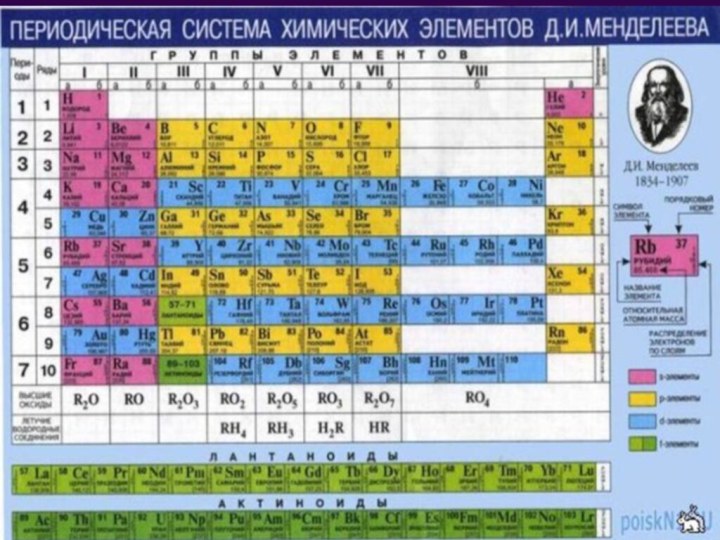
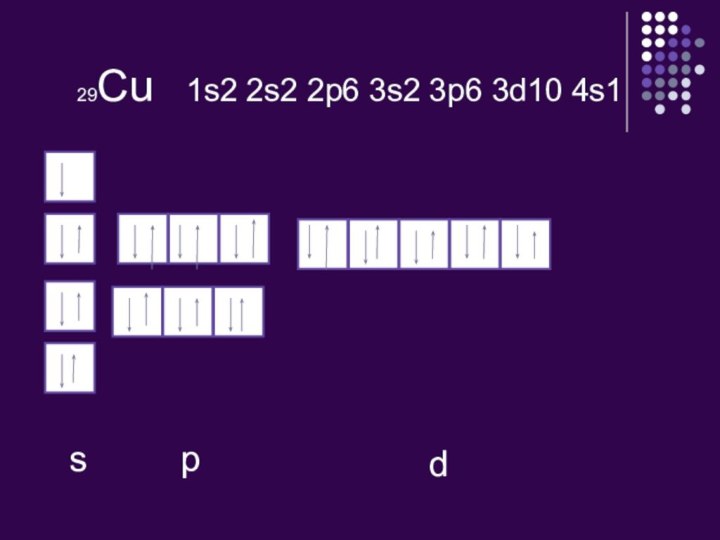
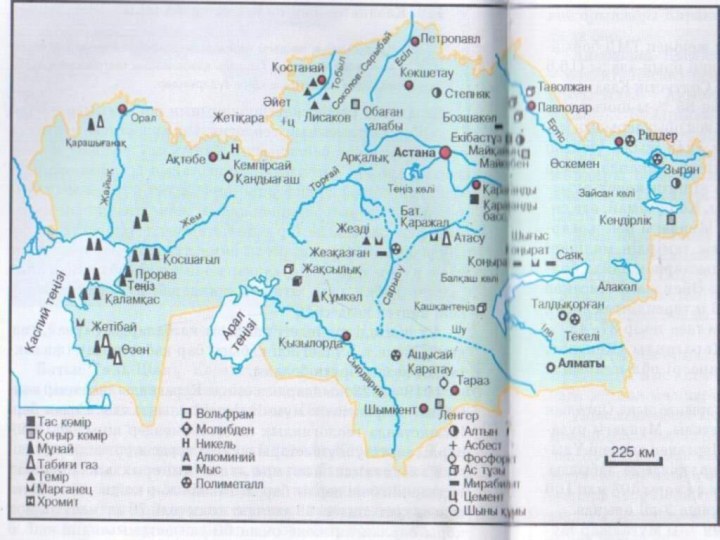
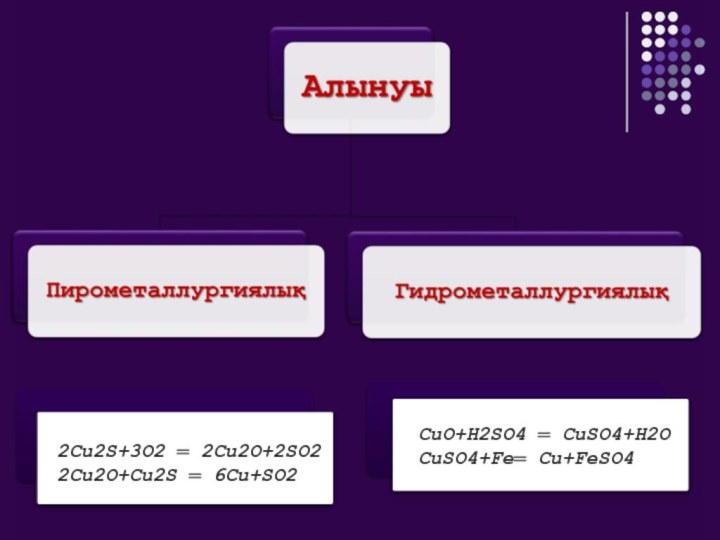
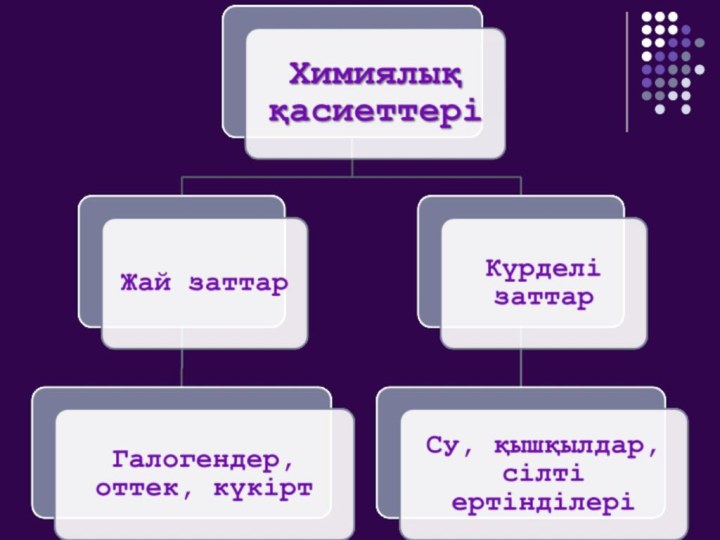
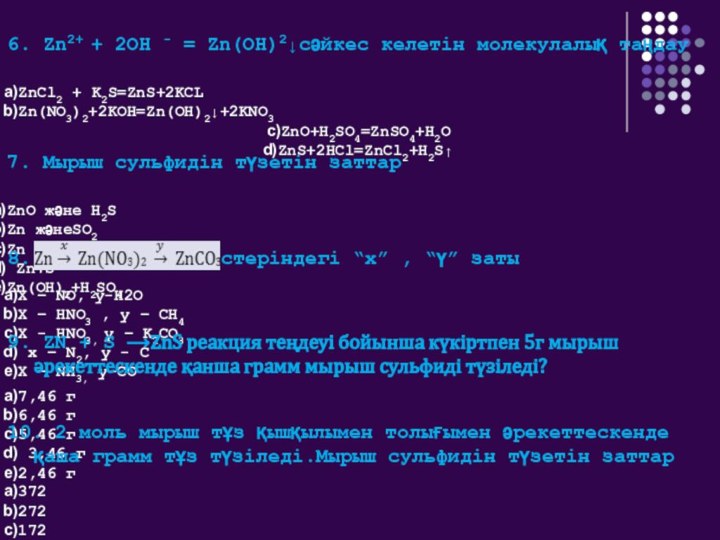
I, IIА топ элементтері қандай элементтерге
жатады?3. IА топ элементтерін қалай атайды?
Неге сілтілік металдар деп аталады?
4. Сілтілік металдардың физикалық қасиеттері қандай?
5. Сілтілік металдардың химиялық қасиеттері қандай?
6. Na, K маңызды қосылыстарын атаңыздар
7. Mg, Ca қандай маңызды қосылыстарын білесіңдер?
8. Қандай тұздар су кермектігін туғызады?