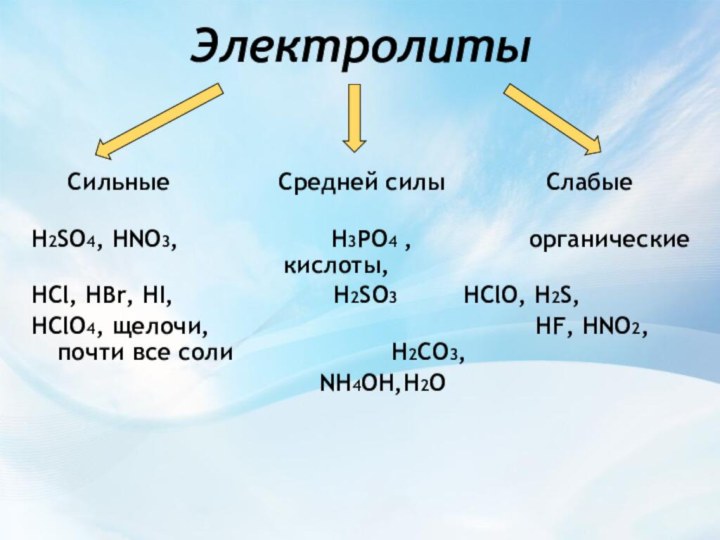
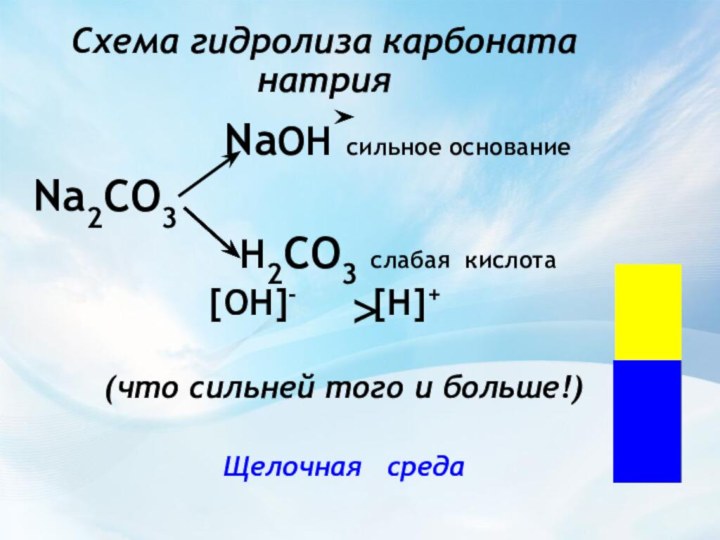
Средней силы
СлабыеH2SO4, HNO3, H3PO4 , органические кислоты,
HCl, HBr, HI, H2SO3 HClO, H2S,
HClO4, щелочи, HF, HNO2, почти все соли H2CO3,
NH4OH,H2O
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть











>
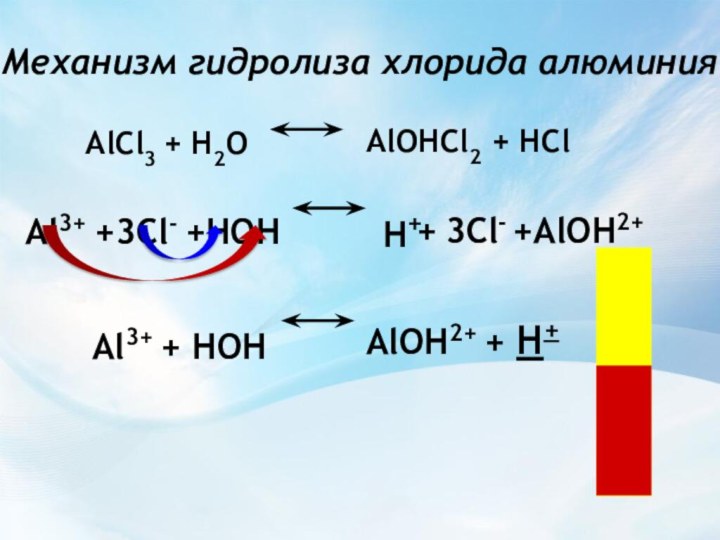
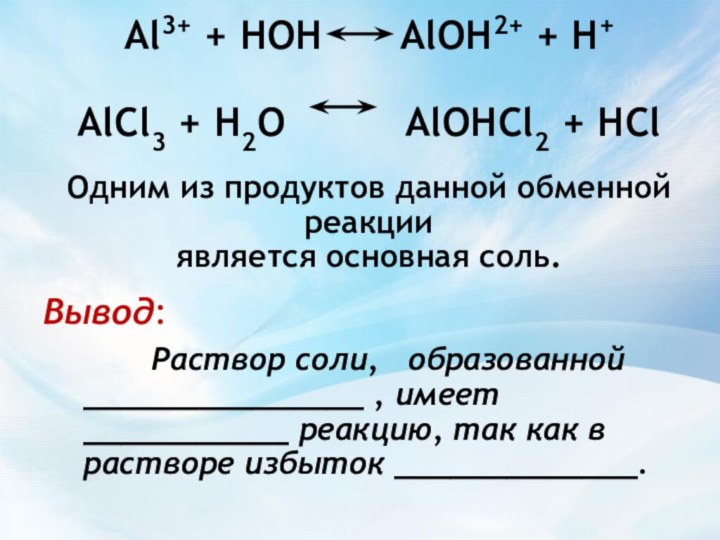
H+
+ 3Cl-
+AlOH2+
AlOH2+ + H+
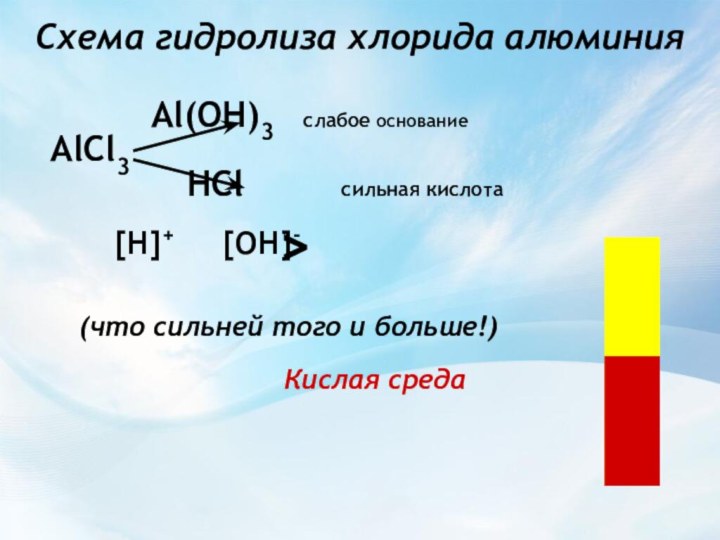
Вывод:
Раствор соли, образованной _______________ , имеет ___________ реакцию, так как в растворе избыток _____________.
>
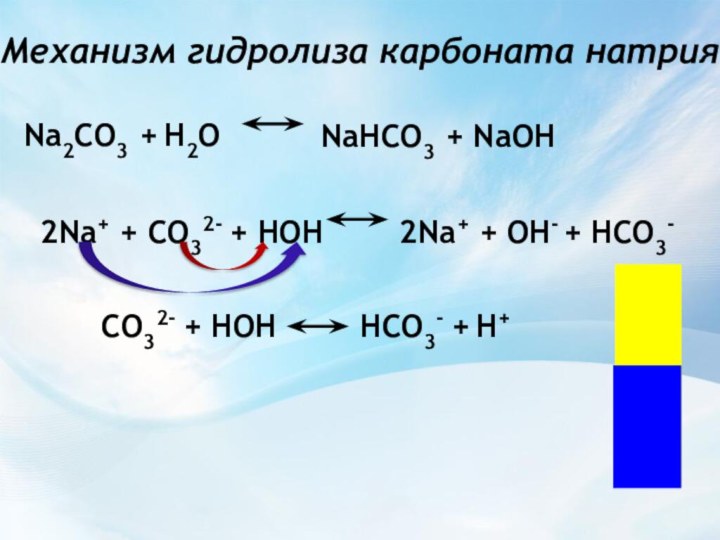
NaНCO3 + NaOH
2Na+ + OH-
+ НCO3-
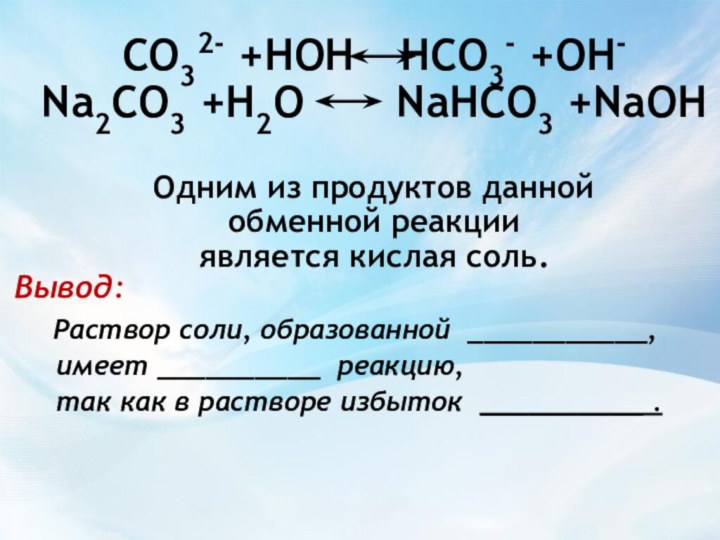
НCO3- + H+
Вывод:
Раствор соли, образованной ___________,
имеет __________ реакцию,
так как в растворе избыток __________ .
=
H+ Cl- +
Na+ + OH-