- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Физические и химические свойства ацетилена
Содержание
- 2. «Физические и химические свойства ацетилена».Впервые ацетилен получил
- 3. 1.Какие непредельные углеводороды вы знаете?В чём особенности
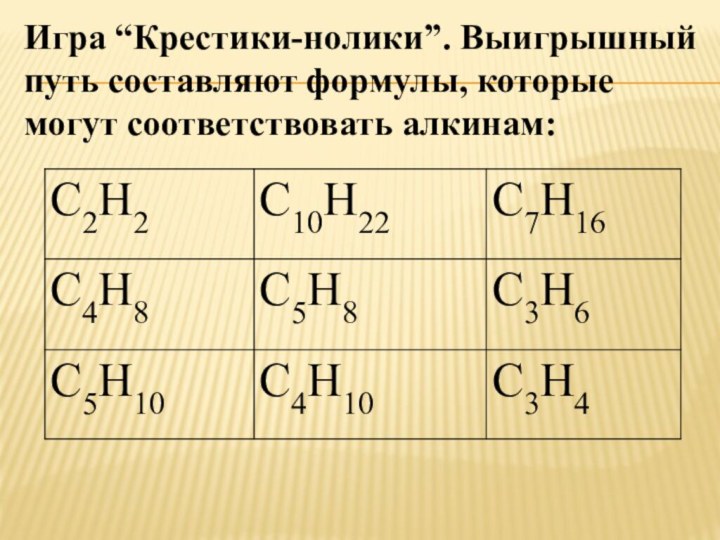
- 4. Игра “Крестики-нолики”. Выигрышный путь составляют формулы, которые могут соответствовать алкинам:
- 5. 6.Вставьте пропущенные символы:Ответ:Углеводороды с общей форулойСnН2n-2 в
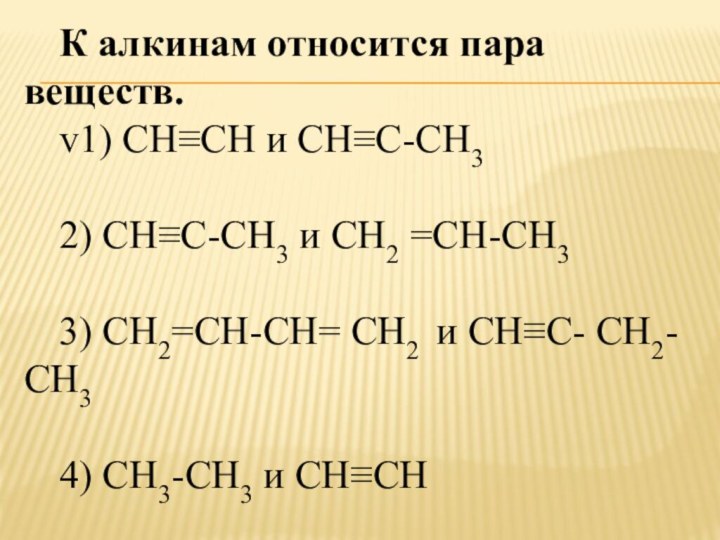
- 6. К алкинам относится пара веществ. v1) СН≡СН
- 7. Гомологи это- 1) пропан и пропин
- 8. 9. Установите соответствие между углеводородами и типами
- 10. Заполнить таблицу «Физические свойства ацетилена». (с. 52)
- 11. Реакции присоединения.
- 12. Гидрирование(в присутствии металлических катализаторов – Pt, Pd, Ni):CH ≡ CH + H2 →CH2 = CH2ацетилен
- 13. Присоединение галогеноводородов:CH ≡ CH + HBr →CH2 = CНBrацетилен
- 14. Гидратация: НgSO4HC ≡ CH + H – OH →
- 15. Горение ацетилена на воздухекоптящим пламенемГОРЕНИЕ АЦЕТИЛЕНААцетиленовая сварка2C2H2 + 5O2 → 4CO2 + 2H2O + Q
- 16. Обесцвечивание щелочного раствора KMnO4 – это качественная реакция
- 17. Реакция полимеризации. Полимеризация
- 18. «Взаимодействие с оксидом серебра»HC≡CH + Ag2O → AgC≡CAg↓+ H2O
- 19. Задание :Закрепление изученного материала. Выполнить тест. Отметить
- 20. Задание Выбрать правильный ответ:1.Состав алкинов выражается общей
- 21. Задание. Какие реакции лежали в основе принципа действия карбидных фонарей, применяемых для освещения в 19-ом веке?
- 22. Решение: В фонарь, наполненный карбидом кальция, по каплям
- 23. Рефлексия.1. Узнал много нового.2.Мне это пригодится в
- 24. Скачать презентацию
- 25. Похожие презентации
«Физические и химические свойства ацетилена».Впервые ацетилен получил в 1836 г. Эдмунд Дэви из карбида калия.Сварочный ацетиленовый генератор.






















Слайд 2
«Физические и химические свойства ацетилена».
Впервые ацетилен получил в
1836 г. Эдмунд Дэви из карбида калия.
Слайд 3
1.Какие непредельные углеводороды вы знаете?
В чём особенности строения
алкинов?
2. Назовите общую формулу ацетиленовых углеводородов.
Какие углеводороды наываются алкинами?
Слайд 4 Игра “Крестики-нолики”. Выигрышный путь составляют формулы, которые могут
соответствовать алкинам:
Слайд 5
6.Вставьте пропущенные символы:
Ответ:Углеводороды с общей форулойСnН2n-2 в молекулах
которых имеется два атома углерода, связанных одной сигма и
двумя пи связями, относят к ряду ацетилена.
Слайд 6
К алкинам относится пара веществ.
v1) СН≡СН и
СН≡С-СН3
2) СН≡С-СН3 и СН2 =СН-СН3
3) СН2=СН-СН= СН2 и СН≡С- СН2-
СН3 4) СН3-СН3 и СН≡СН
Слайд 8
9. Установите соответствие между углеводородами и типами гибридизации.
А. алканы
1. SPБ. алкадиены 2. SP3
В. Алкены 3. SP2
Г. алкины
А Б В Г
2 3 3 1
Слайд 11
Реакции присоединения.
Галогенирование:
CH ≡ CH + Br2 →CHBr = CНBr
ацетилен
1,2-дибромэтенCH ≡ CH + 2 Br2 →CНBr2 – CНBr2 –
Ацетилен 1,1,2,тетрабромэтан
Слайд 12
Гидрирование(в присутствии металлических катализаторов – Pt, Pd, Ni):
CH ≡ CH + H2 →CH2 = CH2
ацетилен
этен
CH ≡ CH +
2 H2 →CH3 – CH3ацетилен этан
Слайд 13
Присоединение галогеноводородов:
CH ≡ CH + HBr →CH2 = CНBr
ацетилен
2-бромэтен
CH ≡ CH + 2 HBr →CH3 – CНBr2
Ацетилен
2,2-дибромэтан
Слайд 15
Горение ацетилена на воздухе
коптящим пламенем
ГОРЕНИЕ АЦЕТИЛЕНА
Ацетиленовая сварка
2C2H2 +
5O2 → 4CO2 + 2H2O + Q
Слайд 16 Обесцвечивание щелочного раствора KMnO4 – это качественная реакция на
непредельные углеводороды (алкины обесцвечиваются быстрее, чем алкены).
«Обесцвечивание перманганата калия
ацетиленом».3CH ≡ CH + 10KMnO4+ 2Н2О →
6СО2 + 10MnO2 +10KOH
Слайд 17
Реакция полимеризации.
Полимеризация в
винилацетилен.
CH ≡ CH + НСI →AICI СН2=СНСI
ацетилен
винилхлоридВинилхлорид способен полимеризоваться:
СН2=СН+ СН2=СН +….→ (- СН-СН-)
| | |
СI CI СI
Слайд 18 «Взаимодействие с оксидом серебра»HC≡CH + Ag2O → AgC≡CAg↓+ H2O
амм.р-р
ацетиленид серебра,белый
Слайд 19 Задание :Закрепление изученного материала. Выполнить тест. Отметить знаком
«+» положения, которые считаете верными, и знаком « -
« номер неверного положения.Вопросы:
1.Ацетилен принадлежит к классу алкинов.
2. Общая формула алкиновСn Н 2 n - 2
3. Ацетилен получают из карбоната кальция и воды.
4.Ацетилен мало растворим в воде.
5. Ацетилен - горючий газ.
6. Ацетилен легче воздуха.
7. Для ацетилена типичной реакцией является реакция замещения.
8. Качественной реакцией на ацетилен является изменение окраски бромной воды и перманганата калия.
Слайд 20
Задание Выбрать правильный ответ:
1.Состав алкинов выражается общей формулой:
1)
CnH2n+2 2) CnH2n 3)
CnH2n-22.Реакция гидрирования – это реакция присоединения:
1) водорода 2) воды 3) галогенводорода
3. Реакцию гидратации впервые осуществил :
1) Менделеев 2) Кучеров 3)Бутлеров
4.Реакция присоединения галогенов называется:
1) гидрирование 2) гидратация 3) галогенирование
5.Вещество с формулой CH≡C-CH3 называется
1) этен 2) пропин 3) пропан.
Слайд 21
Задание.
Какие реакции лежали в основе принципа действия карбидных
фонарей, применяемых для освещения в 19-ом веке?
Слайд 22 Решение: В фонарь, наполненный карбидом кальция, по каплям поступала
вода, а получившийся ацетилен поступал в горелку и использовался
для освещения.
Слайд 23
Рефлексия.
1. Узнал много нового.
2.Мне это пригодится в жизни.
3.
Было над чем подумать.
4. На возникшие вопросы я получил
ответ.5. Поработал добросовестно, цель достигнута.