признакам можно определить, что прошла химическая реакция?
Что называется химическим
уравнением?Какие типы химических реакций вы знаете?
В чем сходство и различие реакции соединения и разложения?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть











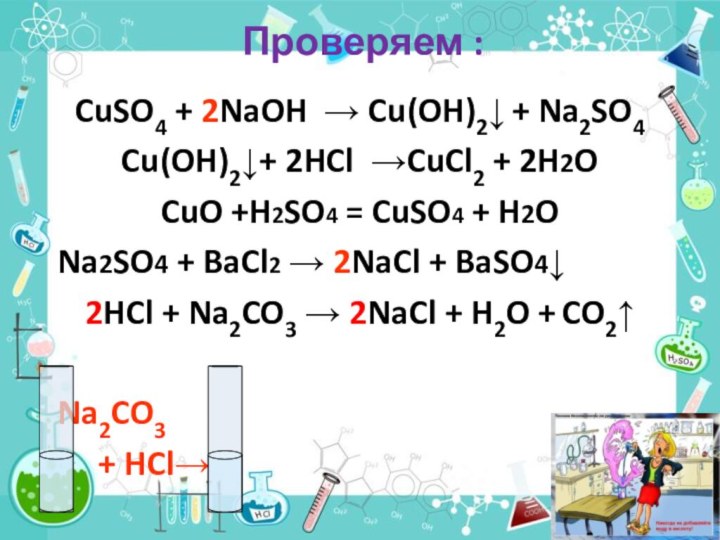





+H2SO4→
BaCl2