нас.
Мы, себя не беспокоя,
Отдаём его тот час.
Нас активней нету, братцы,Это знают все давно.
Нас ножом разрезать можно,
Щёлочь мы с водой даём.
Щелочные металлы
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



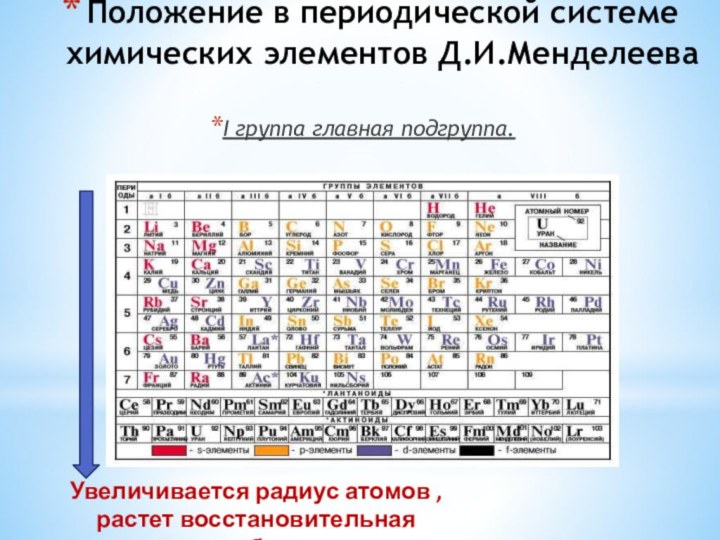

![Презентация по химии Щелочные металлы ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ I ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ LiNaKRbCsFr7233985133[223]2s13s14s15s16s17s1)))))))))))))))))))))))))))увеличиваютсяувеличиваютсяэлементАrВалентные электроныАтомный радиусМетал-лические свойстваВосстано-вительные свойствасоединенияLi2O,](/img/tmb/6/541497/759455a66f8234a8ad42917420d842b9-720x.jpg)















Rb2O, RbOH
основные свойства
Cs2O, CsOH
основные свойства
Радиоактивный
элемент
Калий и рубидий
мягкие щелочные металлы серебристо-белого цвета
Франций-223 (самый долгоживущий из изотопов франция, период полураспада 22,3 минуты) содержится в одной из побочных ветвей радиоактивного ряда урана-235 и может быть выделен из природных урановых минералов
Уран(235),
из которого поучают франций
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22−и надпероксид-ион O2−.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs: