- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Серная кислота 1
Содержание
- 2. Цель урокаИзучить химические свойства и стадии получения серной кислоты
- 3. Химические свойства С основаниями (реакция нейтрализации) H2SO4
- 4. Химические свойства С металлами (стоящие в ряду
- 5. Химические свойства С солями BaCl2
- 6. Концентрированная серная кислотаCu + 2H2SO4 -> CuSO4 + SO2 + 2H2O
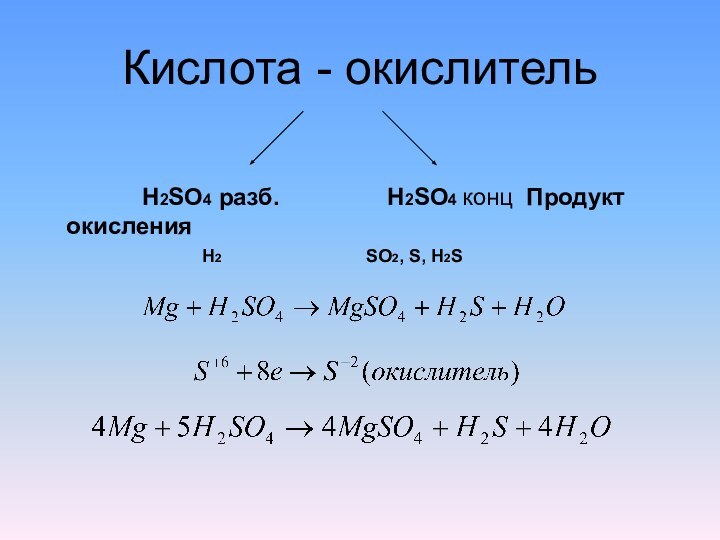
- 7. Кислота - окислитель H2SO4 разб.
- 8. Производство серной кислотыI стадия – получение сернистого газа SO2Получение из пирита
- 9. Производство серной кислотыII стадия – получение SO32-я стадия
- 10. Производство серной кислотыIII стадия – получение H2SO43-я стадия
- 11. Выводы Серная кислота может являться реагентом для
- 12. Проверь себяВариант I
- 13. Скачать презентацию
- 14. Похожие презентации
Цель урокаИзучить химические свойства и стадии получения серной кислоты











Слайд 3
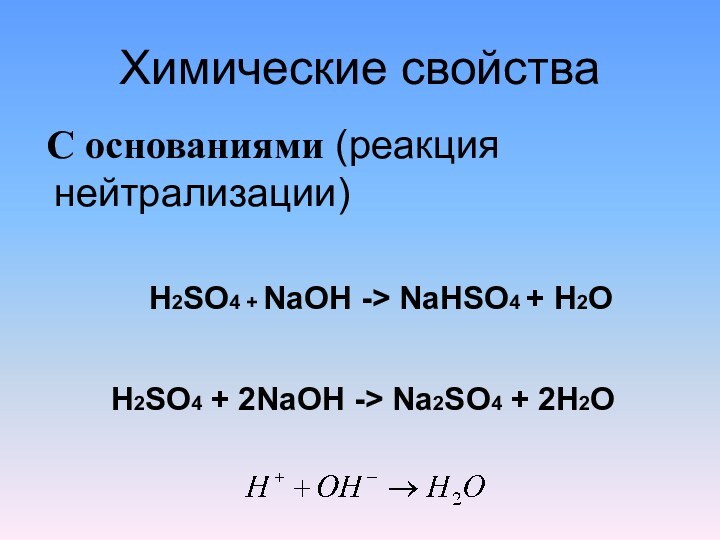
Химические свойства
С основаниями (реакция нейтрализации)
H2SO4 +
NaOH -> NaHSO4 + H2O
H2SO4 + 2NaOH -> Na2SO4
+ 2H2O
Слайд 4
Химические свойства
С металлами (стоящие в ряду напряжения
до водорода)
Zn + H2SO4 -> ZnSO4 + H2
Слайд 5
Химические свойства
С солями
BaCl2 +
H2SO4 -> BaSO4 + 2HCl
Хлорид бария является качественным реактивом
на H2SO4
Слайд 11
Выводы
Серная кислота может являться реагентом для получения
водорода
Серная кислота является сильным окислителем
Серная кислота взаимодействует не только
с металлами стоящие в ряду напряжений до водорода, но и со стоящими после него.Хлорид бария может являться качественным реагентом на сульфат-анион
Производство серной кислоты является сложным многостадийным химическим процессом





























