Слайд 2
«Металлы отверзают недро земное к плодородию; металлы служат
нам в ловлении земных и морских животных для пропитания
нашего; металлы облегчают купечество удобною к сему монетою…
И кратко сказать, ни едино художество, ни едино ремесло простое употребление металлов миновать не может»
(М.В.Ломоносов)
Слайд 3
Металлы в истории человечества
Семь металлов создал свет
По
числу семи планет:
Медь, железо, серебро…
Дал на Космос
на добро.
Злато, олово, свинец…
Сын мой, сера – их отец.
А еще ты должен знать:
Всем им ртуть – родная мать.
Слайд 4
Металлы в истории человечества
Слайд 5
Понятие о металлах
Мета́лл (название происходит от лат.Мета́лл (название
происходит от лат. metallum — шахта) — группа элементов, обладающая характерными металлическими
свойствами, такими как высокая тепло-Мета́лл (название происходит от лат. metallum — шахта) — группа элементов, обладающая характерными металлическими свойствами, такими как высокая тепло- и электропроводностьМета́лл (название происходит от лат. metallum — шахта) — группа элементов, обладающая характерными металлическими свойствами, такими как высокая тепло- и электропроводность, высокая пластичность и др.
Металлы – это химические элементы, атомы которых способны только отдавать электроны, имеют низкие значения электроотрицательности (от 0,7 до 2,0), им соответствуют простые вещества, металлы.
К металлам относятся примерно 70 % всех химических элементов
Слайд 6
Металлы в периодической системе
Левый нижний угол относительно диагонали
В-At + все побочные подгруппы
Слайд 7
Металлы в периодической системе
К элементам - металлам относятся:
s - элементы I и II групп, все d-
и f -элементы,
а также p- элементы главных подгрупп:
III (кроме бора),
IV (Ge, Sn, Pb),
V (Sb,Bi) и VI (Po).
Наиболее типичные элементы – металлы расположены в начале периодов (начиная со второго).
Низшая степень окисления Ме = 0, высшая =№ группы (искл.Ι-Б и VΙΙ-Б).
Слайд 8
Особенности строения атомов металлов
Внешних (валентных) электоронов мало (у
типичных металлов 1-3):
Радиусы атомов большие
ВСЕ МЕТАЛЛЫ ВОССТАНОВИТЕЛИ
Слайд 10
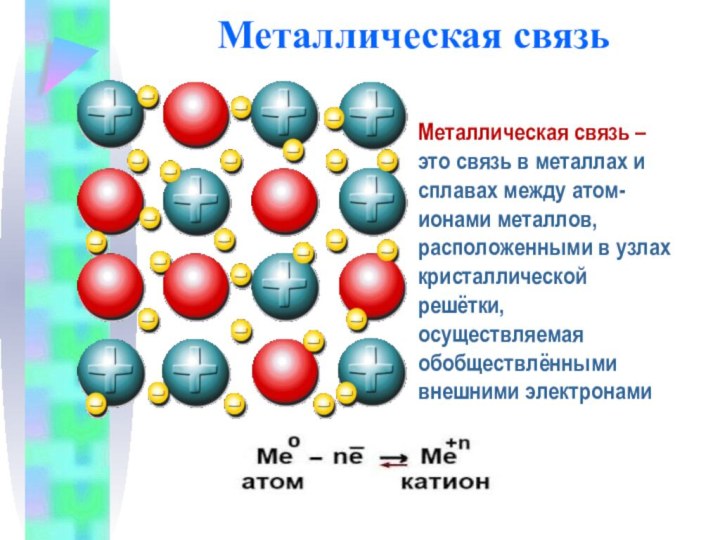
Металлическая связь
Металлическая связь – это связь в металлах
и сплавах между атом-ионами металлов, расположенными в узлах кристаллической
решётки, осуществляемая обобществлёнными внешними электронами
Слайд 11
Кристаллическая решетка в металлах
Слайд 12
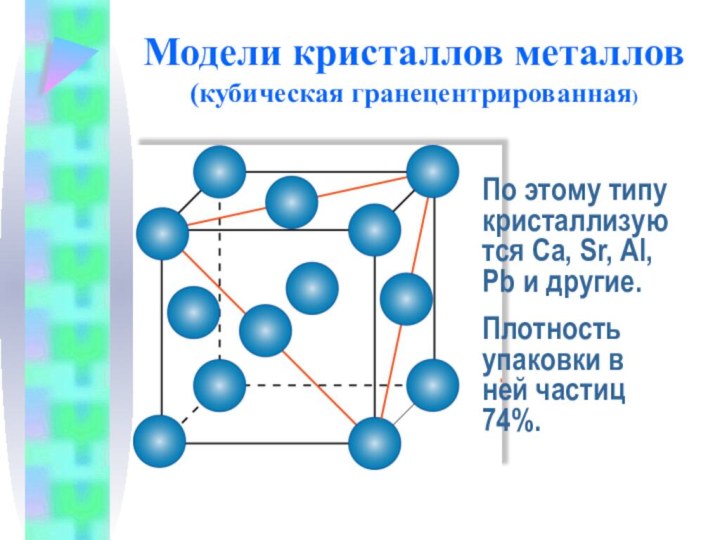
Модели кристаллов металлов
(кубическая гранецентрированная)
По этому типу кристаллизуются Са,
Sr, Al, Pb и другие.
Плотность упаковки в ней частиц
74%.
Слайд 13
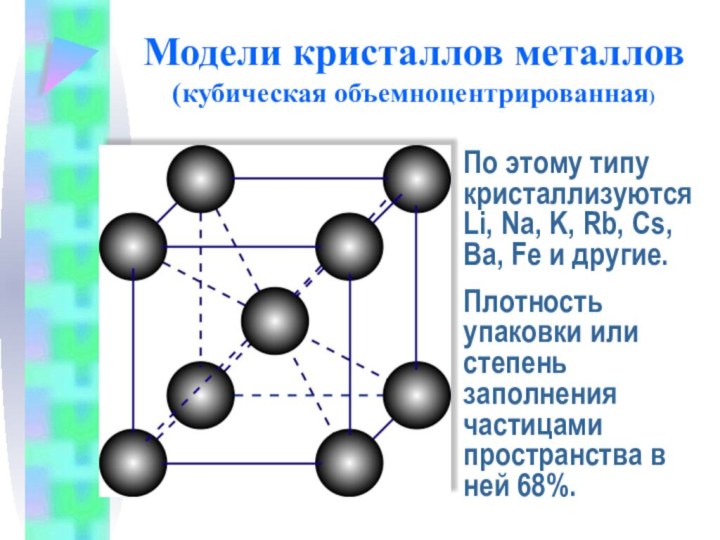
Модели кристаллов металлов
(кубическая объемноцентрированная)
По этому типу кристаллизуютсяLi, Na,
K, Rb, Cs, Ba, Fe и другие.
Плотность упаковки или
степень заполнения частицами пространства в ней 68%.
Слайд 14
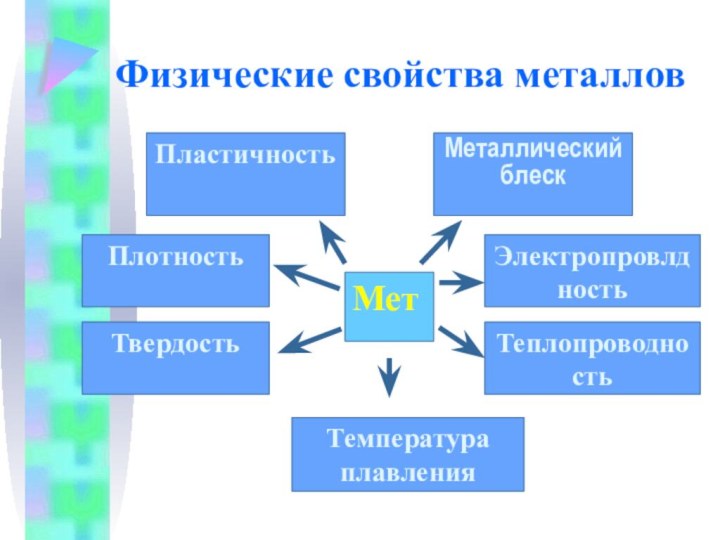
Физические свойства металлов
Мет
Пластичность
Металлический блеск
Плотность
Твердость
Теплопроводность
Электропровлдность
Температура плавления
Слайд 15
Физические свойства металлов
1. Металлический блеск
Самые блестящие металлы –
Hg, Ag, Pd.
В порошке все металлы, кроме Al
и Mg,
теряют блеск и имеют чёрный или
тёмно-серый цвет.
Слайд 16
Физические свойства металлов
2. Электро- и теплопроводность
В ряду Ag→Cu
→ Al → Fe уменьшается.
Наименьшая электропроводность в ряду
Mn → Pb → Hg
При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".
Слайд 17
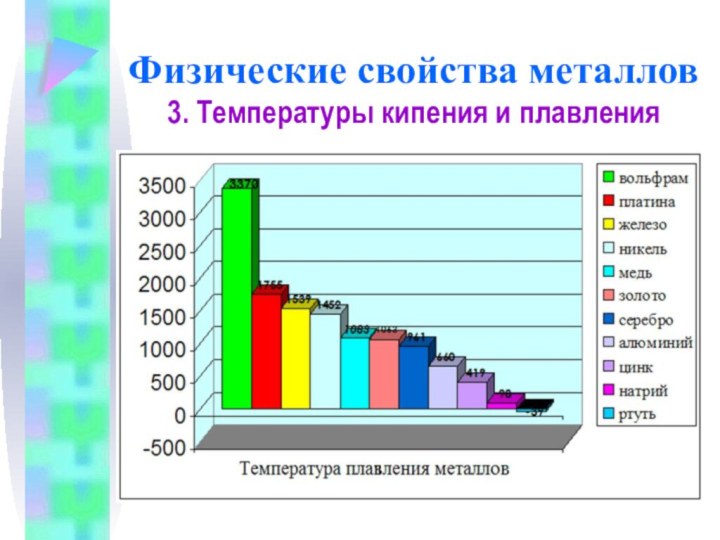
Физические свойства металлов
3. Температуры кипения и плавления
Самый легкоплавкий
металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл
– вольфрам (t°пл. = 3370°C).
Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Ртуть
Вольфрам
Слайд 18
Физические свойства металлов
3. Температуры кипения и плавления
Слайд 19
Физические свойства металлов
4. Твердость
Самый твердый – хром (режет
стекло).
Самые мягкие – щелочные металлы – калий, натрий, рубидий
и цезий – режутся ножом.
Хром
Щелочные металлы
Слайд 20
Физические свойства металлов
3. Твердость
Слайд 21
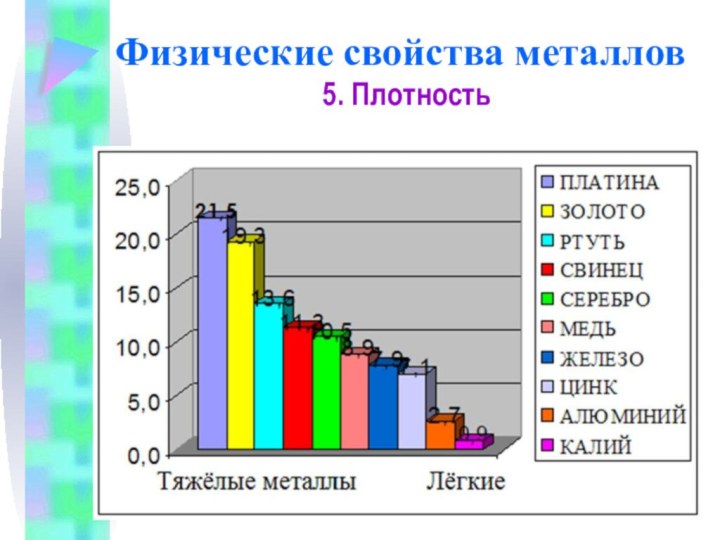
Физические свойства металлов
5. Плотность
Плотность тем меньше, чем меньше
атомная масса металла и чем больше радиус его атома
Самый
легкий – литий (ρ =0,53 г/см3), всплывает в керосине.
Самый тяжелый – осмий (ρ =22,6 г/см3
осмий, не только самый тяжелый, но и самый дорогой металл
Литий – самый лёгкий металл
Золото – один из тяжёлых металлов
Слайд 22
Физические свойства металлов
5. Плотность
Слайд 23
Физические свойства металлов
5. Пластичность
Пластичность - способность изменять форму
при ударе, вытягиваться в проволоку, прокатываться в тонкие листы.
В ряду :
Au→Ag → Cu → Sn → Pb → Zn → Fe уменьшается.
Сусальное золото
Слайд 24
Химические свойства металлов
Взаимодействие с простыми веществами
С кислородом большинство металлов образует
оксиды – амфотерные и основные:
4Li + O2 = 2Li2O,
4Al +
3O2 = 2Al2O3.
Щелочные металлы, за исключением лития, образуют пероксиды:
2Na + O2 = Na2O2.
Слайд 25
Химические свойства металлов
Взаимодействие с простыми веществами
С галогенами металлы образуют соли
галогеноводородных кислот
Cu + Cl2 = CuCl2
С серой металлы образуют
сульфиды – соли сероводородной кислоты
Zn + S = ZnS
Слайд 26
Химические свойства металлов
Взаимодействие с простыми веществами
С азотом некоторые металлы образуют
нитриды, реакция практически всегда протекает при нагревании:
3Mg + N2 = Mg3N2
С углеродом образуются карбиды
4Al + 3C = Al3C4
С фосфором – фосфиды:
3Ca + 2P = Ca3P2.
Слайд 27
Химические свойства металлов
Взаимодействие с простыми веществами
С водородом самые активные металлы
образуют ионные гидриды – солеподобные вещества, в которых водород
имеет степень окисления -1
2Na + H2 = 2NaH
Металлы могут взаимодействовать между собой, образуя интерметаллические соединения
2Na + Sb = Na2Sb,
3Cu + Au = Cu3Au
Слайд 28
Химические свойства металлов
Взаимодействие со сложными веществами
С ВОДОЙ
Активные металлы
энергично взаимодействуют с водой
при
обычных условиях
Ca + 2H2O → Ca(OH)2 + H2↑
Металлы средней активности взаимодействуют с водой при нагревании
3Fe + 4H2O → Fe2O3·FeO + 4H2
Неактивные металлы с водой не реагируют
Слайд 29
Химические свойства металлов
Взаимодействие со сложными веществами
С КИСЛОТАМИ
С растворами
кислот реагируют металлы, которые:
1. в ряду активности стоят до
водорода.
При этом чем левее стоит метал, тем активнее он вытесняет водород;
Li K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Ag Hg Au Вытесняют водород из кислот Не вытесняют водород
2. образуют с этими кислотами растворимые соли.
Это необходимо для того, чтобы на поверхности металла не образовалась защитная солевая пленка
Слайд 30
Химические свойства металлов
Взаимодействие со сложными веществами
С КИСЛОТАМИ
При
взаимодействии металлов с азотной и конц. серной кислотами водород не
выделяется.
Состав продуктов в этих окислительно-восстановительных реакциях зависит от многих факторов: активности металла, концентрации кислоты, температуры. Например:
Cu + 4 HNO3(конц.) =Cu(NO3)2 + 2 NO2 + 2 H2O
3 Cu + 8HNO3(разб.) = 3 Cu(NO3)2 + 2 NO + 4 H2O
8 K + 5 H2SO4(конц.) = 4 K2SO4 + H2S + 4 H2O
3 Zn + 4 H2SO4(конц.) = 3 ZnSO4 + S + 4 H2O
Слайд 31
Химические свойства металлов
Взаимодействие со сложными веществами
С СОЛЯМИ
С солями
менее активных металлов, если образуемая при этом соль растворимая
Слайд 34
Металлы в природе
В САМОРОДНОМ ВИДЕ
золото
серебро
медь
платина
Слайд 35
Металлы в природе
КАРБОНАТЫ
Малахит
Cu2(OH)2CO3
Магнезит
MgCO3
Мрамор CaCO3
Слайд 36
Металлы в природе
ХЛОРИДЫ
Каменная соль NaCl
Карналлит
KCl*MgCl2*6H2O
Сильвин KCl
Слайд 37
Металлы в природе
СУЛЬФИДЫ
Галенит PbS
Пирит FeS2
Медный блеск
CuS
Слайд 38
Металлы в природе
ОКСИДЫ
Магнетит Fe3O4
Лимонит
2Fe2O3* 3H2O
Гематит Fe2O3
Каолин
Al2O3*2SiO2*2H2O
Слайд 39
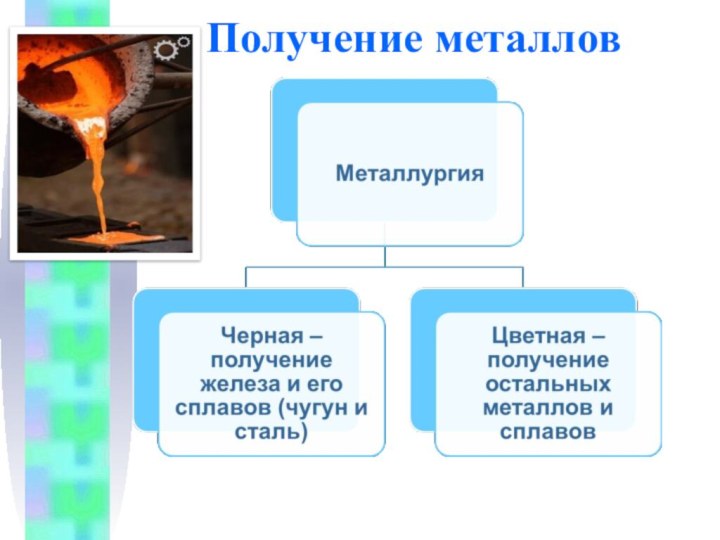
Получение металлов
Минералы и горные породы, содержащие металлы и
их соединения и пригодные для промышленного получения металлов, называются
рудами.
Отрасль промышленности, занимающаяся получением металлов из руд, называется металлургией.
Плавка металла в Древнем Египте (дутьё подаётся мехами, сшитыми из шкур животных).
Слайд 41
Получение металлов
ПИРОМЕТАЛЛУРГИЯ
Восстановление металлов из руд при высоких температурах
с помощью восстановителей.
Соль → оксид
Соли кислородсодержащих кислот –
термическое разложение:
CuCO3 = CuO + CO2
Соли бескислородных кислот- обжиг:
2ZnS + ЗО2 = 2ZnО + 2SО2
Слайд 42
Восстановление углем или угарным газом:
CuO + C →
Cu + CO
CuO + CO → Cu + CO2
Водородотермия:
Cr2O3
+ H2 → Cr + H2O
Металлотермия:
Fe2O3 + Al → Fe + Al2O3
Такими способами получают металлы средней активности и неактивные.
Слайд 43
Получение металлов
ГИДРОМЕТАЛЛУРГИЯ
Получение металлов из растворов их солей.
Перевод нерастворимого
соединения в раствор:
CuO + H2SO4 = CuSO4 + H2O
Восстановление
металла из раствора:
CuSO4 + Fe = FeSO4 + Cu.
Таким способом получают Cu, Ag, Au, Zn, Mo, U и другие металлы.
Слайд 44
Получение металлов
ЭЛЕКТРОМЕТАЛЛУРГИЯ
Электрометаллургия – это способы получения металлов
с помощью электрического тока (электролиза)
2NaCl → 2Na +
Cl2
MgBr2 → Mg + Br2
Слайд 45
Применение металлов
1. Ядерная энергетика (U).
2. Производство осветительных приборов
(W, Mo).
3. Медицина (протезы) (Ti, Ni, Au).
4. Легирующие добавки
для стали (W, Mo, Ni, Cr, V).
5. Ювелирные изделия (Au, Ag, Cu).
6. Защита от коррозии (Ni, Cr).
7. Автомобильный, авиационный, железнодорожный транспорт (Fe, Al, Ti).
8. Строительство (конструкционные материалы) (Fe).
9. Катализаторы (Pt, Fe, Ni и др.) .
10. Электротехническая промышленность (Cu, Al).
Слайд 46
Применение металлов
Металлы составляют одну из основ цивилизации на
планете Земля. Среди них как конструкционный материал явно выделяется
железо. Объем промышленного производства железа примерно в 20 раз больше, чем объем производства всех остальных металлов, вместе взятых. Широкое внедрение железа в промышленное строительство и транспорт произошло на рубеже XVIII...XIX вв. В это время появился первый чугунный мост, спущено на воду первое судно, корпус которого был изготовлен из стали, созданы первые железные дороги. Однако начало практического использования человеком железа относят к IX в. до н.э. Именно в этот период человечество из бронзового века перешло в век железный
Слайд 47
Применение металлов
В медицине благородные металлы применяют для изготовления
инструментов, деталей приборов, протезов, а также различных препаратов, главным
образом на основе серебра. Сплавы платины с иридием, палладием и золотом почти незаменимы при изготовлении игл для шприцев. Из медицинских препаратов, содержащих благородных металлов, наиболее распространены ляпис, протаргол и др. Благородные металлы применяют при лучевой терапии (иглы из радиоактивного золота для разрушения злокачественных опухолей), а также в препаратах, повышающих защитные свойства организма.
Слайд 48
Применение металлов
Хорошо известно бактерицидное действие малых концентраций серебра
на
питьевую воду. При содержании ионов этого металла 10—30 мг
на 1 т воды
предотвращается рост бактерий и других микроорганизмов. При этом вкус
воды не изменяется. Вот почему препараты на основе серебра все шире
используются для стерилизации питьевой воды. В бытовые фильтры иногда
помещают «посеребренный» активированный уголь, выделяющий в воду малые
количества серебра и являющийся одновременно адсорбентом.
Слайд 49
Применение металлов
В электротехнической промышленности алюминий и его сплавы
применяют для изготовления кабелей, шинопроводов, конденсаторов, выпрямителей переменного тока.
В приборостроении используется при производстве кино- и фотоаппаратуры, радиотелефонной аппаратуры, различных контрольно-измерительных приборов.
Алюминий начали широко применять при изготовлении аппаратуры для производства и хранения крепкой азотной кислоты, пероксида водорода, органических веществ и пищевых продуктов благодаря его высокой коррозионной стойкости и нетоксичности.
Алюминиевая фольга стала очень распространенным упаковочным материалом, так как она гораздо прочнее и дешевле оловянной. Также алюминий стал широко использоваться для изготовления тары для консервирования и храпения продуктов сельского хозяйства. Но хранение не ограничивается маленькими баночками, алюминий используется для строительства зернохранилищ и других быстровозводимых сооружений, востребованных в сельском хозяйстве.