Слайд 2
Теория Аррениуса
Кислота: HCI ⮀ H+ + CI-
Основание: NaOH
⮀ Na+ + OH-
Амфолит: H2O ⮀ H+ + OH-
Zn(OH)2
+ 2HCI = ZnCI2 + 2H2O
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Слайд 3
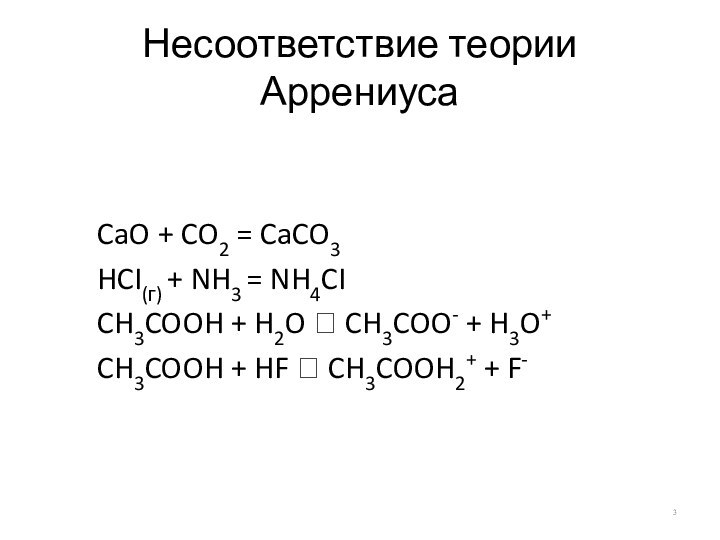
Несоответствие теории Аррениуса
CaO + CO2 = CaCO3
HCI(г) +
NH3 = NH4CI
CH3COOH + H2O ⮀ CH3COO- + H3O+
CH3COOH
+ HF ⮀ CH3COOH2+ + F-
Слайд 4
Протолитическая теория
Определение кислоты и основания включает в себя
молекулы и ионы, способные принимать и отдавать H+
Кислота –
донор протонов
Основание – акцептор протонов
Амфолит – донор и акцептор протонов
Слайд 5
Классификация кислот
Нейтральные кислоты (HCI, HNO3, CH3COOH, H2SO4, H3PO4)
HCI
→ H+ + CI-
Анионные кислоты (HSO4-, H2PO4-)
H2PO4- → +
HPO42-
Катионные кислоты (NH4+, H3O+)
NH4+ → NH3 + H+
Слайд 6
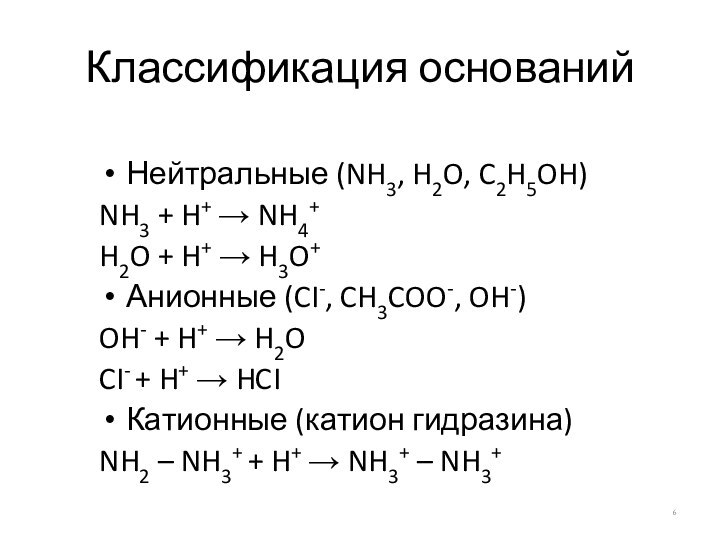
Классификация оснований
Нейтральные (NH3, H2O, C2H5OH)
NH3 + H+ →
NH4+
H2O + H+ → H3O+
Анионные (CI-, CH3COO-, OH-)
OH- +
H+ → H2O
CI- + H+ → HCI
Катионные (катион гидразина)
NH2 – NH3+ + H+ → NH3+ – NH3+
Слайд 7
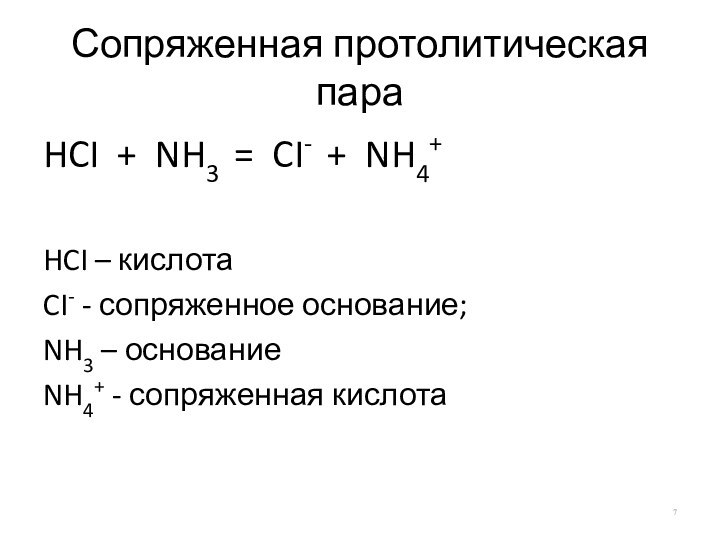
Сопряженная протолитическая пара
HCI + NH3 = CI- +
NH4+
HCI – кислота
CI- - сопряженное основание;
NH3 – основание
NH4+ -
сопряженная кислота
Слайд 8
Роль растворителя
Растворитель влияет на проявление кислотных и основных
свойств
Протогенный (вода, спирты, уксусная, серная кислоты, жидкий хлористый водород)
Протофильный
(вода, спирты, жидкий аммиак, амины)
Апротонный (бензол, толуол, CCI4, дихлорэтан)
Слайд 9
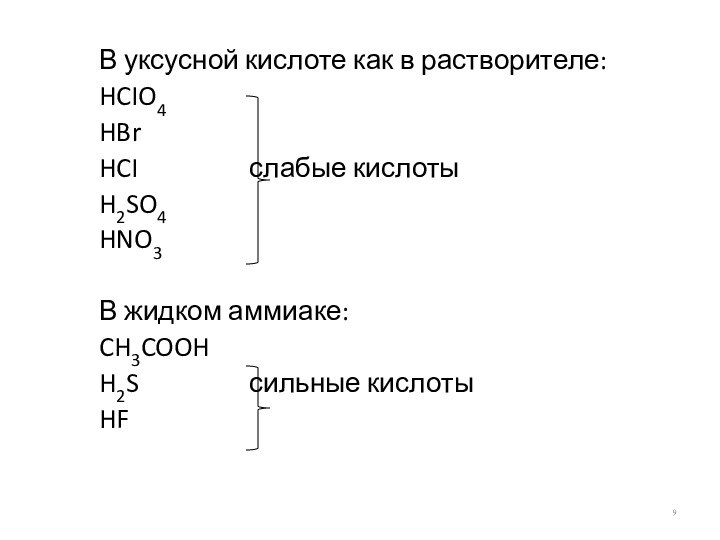
В уксусной кислоте как в растворителе:
HCIO4
HBr
HCI слабые
кислоты
H2SO4
HNO3
В жидком аммиаке:
CH3COOH
H2S сильные кислоты
HF
Слайд 10
Протолитические реакции
Диссоциации
Нейтрализации
Гидролиза
Слайд 11
Диссоциация воды
Диссоциация воды
H2O ⮀ H3O+ + OH-
2H2O ⮀
H+ + OH-
В состоянии равновесия
[H+][OH-]
КД(H2O) = --------------
[H2O]
КД(H2O)
= 1,8⋅10-16
[H+][OH-] = =КД(H2O)⋅[H2O]
1000
CM(H2O) = ------ = 55,6
18
[H+][OH-] =
= 1,8⋅10-16 ⋅55,6 =1⋅10-14
Слайд 12
Ионное произведение воды
Величина постоянная для растворов кислот, оснований
и солей при постоянной температуре
Концентрации [H+] и [OH-] –
сопряженные величины
Активная реакция среды выражается концентрацией [H+]
Кислота: [H+] > [OH-] > 1⋅10-7 (10-6, 10-5)
Основание: [H+] < [OH-] < 1⋅10-7 (10-8, 10-9)
Слайд 13
Водородный показатель
рН = - lg [H+]
Если [H+] =
1⋅10-5; рН = -lg 10-5 = 5
[OH-] = 1⋅10-9;
рOH = -lg 10-9 = 9
Величины рН и рOH являются сопряженными и в сумме составляют всегда 14. Значения рН могут колебаться от 0 до 14:
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
--------- ------- --------- ---------------
сильно кислая слабо кислая слабо щелочная сильно щелочная
рН – количественная мера активной реакции среды
Слайд 14
Кислотность
Активная – концентрация ионов водорода в растворе
CH3COOH ⮀
H+ + CH3COO-
Потенциальная – концентрация нераспавшихся молекул кислоты
Общая –
исходная концентрация или сумма распавшихся и нераспавшихся молекул
Слайд 15
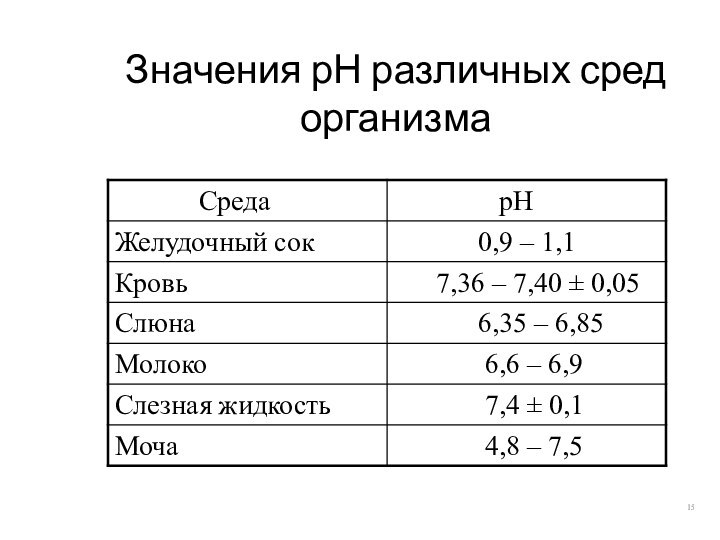
Значения рН различных сред организма
Слайд 16
Роль активной реакции среды
Определяет активность ферментов
Действие клеточных мембран
Устойчивость
коллоидных растворов организма
Определение рН необходимо для изучения функционального состояния
организма, в лабораторной практике, в технологических процессах, в производстве медикаментов, пищевых продуктов
Слайд 17
Методы определения рН
Колориметрический – основан на изменении цвета
раствора в зависимости от реакции среды. При этом используются
кислотно-основные индикаторы (обладает невысокой точностью)
Электрометрический (потенциометрический) – основан на измерении электродных потенциалов
Слайд 18
Индикаторы
Сложные органические вещества, которые в химическом плане представляют
собой слабые кислоты или основания и обладают способностью изменять
свою окраску в зависимости от реакции среды
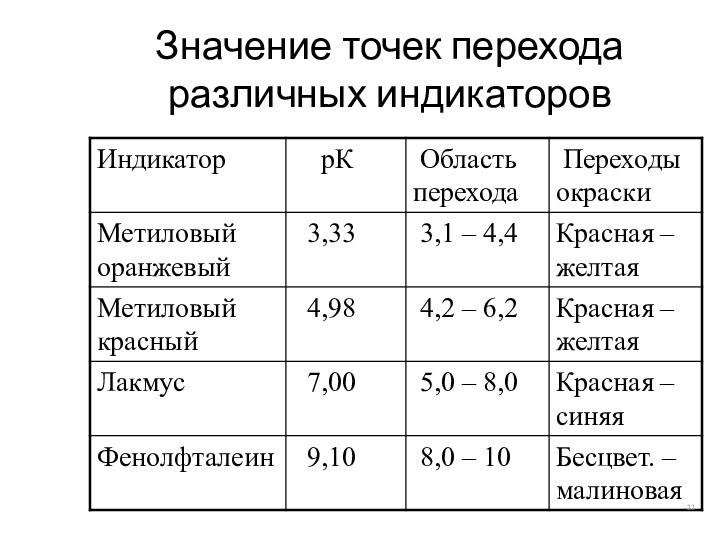
Одноцветные (фенолфталеин)
Двухцветные (лакмус, метиловый оранжевый, метилрот)
Слайд 19
Теория Оствальда
HInd – индикатор-кислота
IndOH – индикатор-основание
HInd ⮀ H+
+ Ind-
IndOH ⮀ OH- + Ind+
Слайд 20
Изменение окраски индикатора
Метилрот
Кислота H+: HInd ← H+ +
Ind- красная
Основание OH-: HInd → H+ + Ind- желтая
Изменяя
реакцию среды, можно влиять на процесс диссоциации и менять соотношение разноокрашенных частиц
Слайд 21
Диссоциация индикатора
Индикаторы – слабые электролиты
[H+][Ind-]
Кд = -------------
[HInd]
[HInd]
[H+]
= Кд------------
[Ind-]
При [HInd] = [Ind-] –
окраска промежуточная, оранжевая
[HInd]
-------- = 1, и тогда
[Ind-]
[H+] = Кд;
-lg[H+] = -lgКд
рН = рК
То значение рН, при котором количества недиссоциированных молекул равны – точка перехода индикатора (рК)
Слайд 22
Значение точек перехода различных индикаторов
Слайд 23
Зона перемены окраски индикатора
Та область значений рН, в
которой происходит различимое глазом изменение цвета индикатора
Чем уже эта
зона, тем чувствительнее индикатор, тем точнее определение рН. Обычно величина зоны перемены окраски индикатора составляет примерно 2 ед. рН (рН = рК ± 1)
Слайд 24
Универсальный индикатор
Смеси различных индикаторов с разными, но примыкающими
друг к другу или перекрывающими зонами перемены окраски
При помощи
таких индикаторов удается определять значение рН от 1 до 12, однако точность лежит в пределах 0,5 – 1,0 рН
Слайд 25
Безбуферный метод определения рН (метод Михаэлиса)
Основан на использовании
набора одноцветных индикаторов нитрофенолового ряда. Окраска исследуемого раствора сравнивается
с образцами этого набора
Точность метода не превышает 0,1 рН
Этим методом рН растворов может быть определено в интервалах от 2,8 до 8,4
Слайд 26
Буферный метод определения рН
Основан на сравнении окраски индикатора
в исследуемом растворе с цветной шкалой, получаемой добавлением одного
индикатора к ряду буферных растворов с различным рН
Совпадение окраски исследуемого раствора с окраской одного из эталонов указывает на совпадение их рН
Метод очень трудоемок, редко используется








![Протолитическая теория кислот и оснований Водородный показательрН = - lg [H+]Если [H+] = 1⋅10-5; рН = -lg](/img/tmb/15/1452322/2f6f026138d3a7f79a09dc0afaff6c17-720x.jpg)






![Протолитическая теория кислот и оснований Диссоциация индикатораИндикаторы – слабые электролиты [H+][Ind-]Кд = ------------- [HInd] [HInd][H+] = Кд------------](/img/tmb/15/1452322/bac4195c7e6ad37d145cb7c159226d73-720x.jpg)